Лечение болезней
воскресенье
Трансплантация печени
Показание м к пересадке печени является терминальная стадия развития цирроза печени, вызванного неумеренным употреблением алкоголя, гепатитом С или В, аутоиммунным гепатитом. Часто показанием к операции является первичная холестатическая болезнь печени, фульминантная печеночная недостаточность, атрезия желчных путей. Значительно реже трансплантацию печени производят при доброкачественных и злокачественных опухолях, у детей — при атрезии желчных путей и некоторых метаболических заболеваниях.
Выбор реципиента. Успешность трансплантации печени зависит от корректного выбора реципиента. Главным является состояние его здоровья к моменту пересадки, способность перенести тяжелую операцию. Реципиент не должен иметь других тяжелых заболеваний в конечной фазе их развития. За 6 мес до операции больной не должен употреблять алкоголя и наркотиков. Операция не показана при наличии внепеченочного онкологического заболевания и не поддающейся излечению инфекции.
Кандидат на пересадку печени должен быть тщательно обследован специалистами разных областей медицины, включая психиатра. До операции необходимо провести лечение имеющихся заболеваний, которые могут повлиять на успешность трансплантации.
Выбор донора. Пересаженная печень должна немедленно выполнять свою синтетическую функцию. В противном случае наступит смерть в ближайшие 72 ч, так как для поддержания ее функции нет никаких устройств, подобных искусственной почке. Нефункционирующую после трансплантации печень удаляют и производят повторную пересадку. Только здоровая печень
1 — нижняя полая вена; 2 — печеночная артерия; 3 — воротная вена; 4 — общий желчный проток (перевязан); 5 — анастомоз желчного пузыря с петлей тонкой кишки; 6 — сегмент печени; 7 — анастомоз желчного протока с петлей тощей кишки; 8 — селезеночная артерия; 9 — селезеночная вена.
донора способна выполнять свою функцию сразу после пересадки. Печень необходимо брать у донора с мозговой смертью и нормально функционирующим сердцем. Трансплантат должен по размерам соответствовать или быть немного меньше печени реципиента. При значительной величине печени донора предпочтение отдают пересадке левой доли (2, 3, иногда 4 сегмента) печени. Трансплантат считается малопригодным, если при биопсии выявляется, что 40 % и более паренхимы печени замещено жиром.
Пересадка сердце—легкие
Успешная трансплантация этих органов единым комплексом была разработана Reitz и сотрудниками. Метод постепенно внедряется в клиники. Основное препятствие — недостаток подходящих доноров.
Показани я к пересадке сердца и легких: 1) первичная легочная гипертензия, синдром Эйзенменгера, 2) кистозный фиброз легких, 3) дефицит а, -антитрипсина.
Выбор донора. Донор по размерам, по возможности, должен соответствовать реципиенту или быть немного меньше, иметь здоровые легкие (по данным рентгенологического исследования), нормальные показатели по газообмену. Естественно, донор должен соответствовать реципиенту по группе крови и по гистосовместимости.
Выбор реципиента. Возраст — не старше 50 лет. В качестве реципиента выбирают пациентов с заболеванием сосудов легких или паренхимы в сочетании с конечной стадией декомпенсации сердца.
У реципиента не должно быть необратимых заболеваний или дисфункции других органов и ранее перенесенных торакотомии или стернотомии.
Операцию начинают так же, как при пересадке сердца. Легкие удаляют поодиночке с помощью сшивающего аппарата, накладываемого на корень легкого. Затем мобилизуют трахею с проксимальными культями бронхов и пересекают ее над кариной. После удаления легких и сердца реципиента подготовленный консервированный трансплантат помещают в грудную полость реципиента и последовательно соединяют швами. Сначала накладывается анастомоз на трахею (бронх при односторонней пересадке), после создания которого легкие начинают вентилировать. Затем накладывают анастомозы между аортой донора и правым предсердием.
Выживаемость после успешной трансплантации сердца и легких такая же, как при пересадке сердца. Иммуносупрессию проводят по тем же правилам. Возможные осложнения — реакция отторжения, кровотечение, обтурирующий бронхолитиаз, который сдерживает широкое распространение метода.
Критерии отбора доноров.
Пересадку сердца выполняют только в отделениях сердечной хирургии, располагающих опытом проведения искусственного кровообращения с холодовой кардиоплегией, где имеются соответствующее оснащение и квалифированный персонал.
Оперативный доступ — срединная стернотомия. После вскрытия перикарда вводят канюли в нижнюю и верхнюю полые вены для подключения аппарата искусственного кровообращения. Продолжительность искусственного кровообращения и холодовой кардиоплегии должна быть возможно короче.
Сердце донора и реципиента иссекают почти полностью, оставляя небольшие участки задних стенок обоих предсердий (места впадения полых вен в правое предсердие и место впадения легочных артерий в левое предсердие). После осмотра подготовленного соответствующим образом сердца донора его соединяют швами с оставшейся задней стенкой левого предсердия, перегородкой между ними, остатком правого предсердия, аортой и легочной артерией реципиента. После снятия зажима с аорты принимают меры для скорейшего восстановления сокращений сердца, если оно не восстанавливается самостоятельно.
Иммуносупрессию проводят по общим правилам. В последние годы в схему иммуносупрессии включают моноклональные антитела (ОКТЗ и др.). В течение первого года после операции выживает около 80 % пациентов, после 5 лет — около 64 % и после 10 лет и более — 45 %.
Реакция отторжения проявляется аритмией, гипотензией, повышением температуры, слабостью, нехваткой воздуха. ЭКГ недостаточно информативна. Для выявления ранних признаков реакции отторжения используют чрезвенозную эндокардиальную биопсию миокарда с последующим изучением его гистологической структуры. Рутинно используют также радиоизотопную вентрикулографию, которая позволяет следить за реакцией отторжения и изменениями в процессе лечения иммуносупрессантами.
Трансплантация сердца
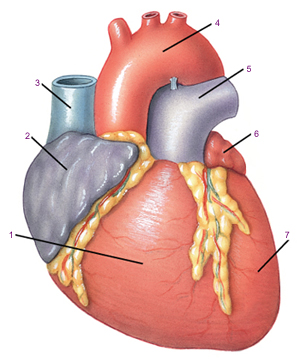
а — общий вид после удаления сердца реципиента; б — вид после завершения операции трансплантации. 1 — нижняя полая вена; 2 — верхняя полая вена; 3 — аорта; 4 — легочная артерия; 5 — задняя стенка левого предсердия; 6 — задняя стенка правого предсердия (реципиента); 6 — правое предсердие донорского сердца; 7 — пересаженное донорское сердце.
Показаниям и к трансплантации сердца являются хроническая ишемическая болезнь сердца в терминальной стадии развития болезни (около 45 % всех трансплантаций сердца), кардиомиопатия с явлениями выраженной сердечной недостаточности (45 %), тяжелые комбинированные пороки сердца, значительно реже — другие виды заболеваний сердца.
Критериями отбора реципиентов для трансплантации сердца являются:
1) сердечная недостаточность IV степени по классификации Нью-Йоркской ассоциации кардиологов или предполагаемая продолжительность жизни пациента менее 6 мес;
2) возраст реципиента — от периода новорожденное™ до 60 лет (в некоторых центрах до 65 лет);
3) удовлетворительное состояние пациента до появления признаков конечной стадии развития сердечного заболевания; у реципиента должна быть нормальная функция или легко обратимая, временная дисфункция легких, печени, почек, ЦНС, а также эмоциональная стабильность и коммуникабельность;
4) резистентность легочных сосудов должна быть нормальной или поддающейся фармакологической коррекции;
5) у реципиента не должно быть активно развивающейся инфекции или онкологического процесса, недавно перенесенной тромбоэмболии легочной артерии, тяжелого сосудистого заболевания.
При выборе метода лечения врач должен быть уверен в том, что пересадка сердца является единственным способом продлить жизнь больного, что все возможности других методов лечения тяжелого сердечного заболевания исчерпаны.
Противопоказаниями к трансплантации сердца являются: 1) системные заболевания (например, инсулинзависимый сахарный диабет, не поддающиеся коррекции хронические заболевания почек, ЦНС, психические заболевания, активная инфекция в организме); 2) высокое давление в системе легочной артерии (легочная гипертензия); 3) выраженное ожирение, алкоголизм или наркомания.
Иммуносупрессивная терапия
После успешной пересадки поджелудочной железы углеводный обмен нормализуется, пациент избавляется от необходимости вводить инсулин, но зато должен принимать иммуносупрессивные препараты. Основная цель одновременной пересадки панкреас и почки заключается в том, чтобы остановить прогрессирование нефропатии, ретинопатии, нейропатии. Как правило, это удается достичь, качество жизни пациентов становится намного лучше по сравнению с жизнью на фоне гемодиализа.
Теоретически можно добиться нормогликемии путем трансплантации клеток островков Лангерганса, практически — крайне трудно. Для этого необходимо измельчить панкреас донора, подвергнуть смесь клеток воздействию коллагеназы и затем отцентрифугировать клетки островков Лангерганса на специальной центрифуге. Из одной панкреатической железы удается получить очень мало жизнеспособных клеток для введения их в портальную вену, в ткань селезенки или под капсулу почки. Эта методика находится в начальной стадии разработки. Делаются попытки пересадки поджелудочной железы от 16—20-недельного эмбриона. Его размер едва достигает 0,5 см, а масса поджелудочной железы 10—20 мг. Железа способна расти и выделять инсулин в течение непродолжительного времени. В мире сделано около 200 экспериментальных пересадок эмбриональной поджелудочной железы с очень ограниченным успехом.
Трансплантация поджелудочной железы
Показани я к пересадке поджелудочной железы являются противоречивыми. Не вызывает сомнения, что пересадка должна быть произведена до появления тяжелых или необратимых осложнений сахарного диабета, таких как тяжелая ретинопатия, угрожающая слепотой, нейропатия, нефропатия, тяжелое заболевание микрососудов и крупных стволов.
Противопоказани я к трансплантации поджелудочной железы такие же, как к трансплантации почки и других органов. Особенно тщательно должно быть исследовано сердце реципиента. В связи с нейропатией многие пациенты не ощущают стенокардию даже при значительном поражении коронарных сосудов. Для уточнения диагноза рекомендуется провести радиоизотопное исследование сердца, ангиографию коронарных сосудов.
Выбор донора и изъятие поджелудочной железы имеют большое значение для успеха трансплантации. Поджелудочную железу берут обычно у молодого, здорового донора с мозговой смертью. Возраст донора может колебаться от 3 до 55 лет. У взрослых доноров необходимо исключить атеросклеротическое поражение чревного ствола. Абсолютным противопоказание м для изъятия поджелудочной железы у донора является инфекция в брюшной полости, травма железы, острый панкреатит и наличие диабета у донора. Содержание глюкозы и амилазы в крови донора не отражает состояние и пригодность поджелудочной железы для трансплантации. Панкреас изымают вместе с печенью и двенадцатиперстной кишкой или отдельно. После изъятия органов печень отделяют от поджелудочной железы. Последнюю консервируют в специальном растворе (Виспан, ДюПонт) и сохраняют в контейнере при низкой температуре до момента пересадки. Максимальный срок хранения консервированного органа 20—30 ч.
Для пересадки используется либо сегмент (хвост и тело), либо вся поджелудочная железа вместе с сегментом двенадцатиперстной кишки. Существуют различные мнения по поводу отведения экзокринного сока. Выводной проток панкреас может быть перевязан, блокирован специальным полимером или оставлен открытым (тогда панкреатический сок выделяется в свободную брюшную полость), соединен соустьем с изолированной по Ру петлей тонкой кишки, мочевым пузырем или мочеточником.
При пересадке целой поджелудочной железы вместе с сегментом двенадцатиперстной кишки последний соединяют анастомозом бок в бок с тонкой кишкой или мочевым пузырем. При пересадке сегмента поджелудочной железы выводной проток ее чаще блокируют неопреном или другим быстро отвердевающим синтетическим материалом. Однако эта методика менее популярна по сравнению с отведением панкреатического сока в кишку или мочевой пузырь. При отведении панкреатического сока в мочевой пузырь уменьшается опасность инфекции, появляется возможность контролировать содержание амилазы в моче и судить о начинающейся реакции отторжения и функциональном состоянии трансплантата, поэтому эту методику часто используют в ряде центров. Недостатком соединения протока железы с мочевым пузырем является потеря большого количества бикарбонатов с панкреатическим соком, развитие ацидоза, гематурии, инфекции мочевого пузыря, стриктуры уретры.
Поджелудочную железу, как и почку, пересаживают в подвздошную ямку. При этом последовательно соединяют вены, артерии, выводной проток железы. Принято три варианта пересадки поджелудочной железы: пересадка только железы (у больных
в преуремическом состоянии), почки, а потом поджелудочной железы. Кажущееся преимущество послепочка.
довательной пересадки состоит в том, что панкреас пересаживают на фоне иммуносупрессивной терапии, проводимой по поводу пересаженной ранее почки. Однако результаты последовательной пересадки оказались хуже одновременной пересадки почки и поджелудочной железы. Поэтому в большинстве случаев теперь производят одновременную пересадку обоих органов.
При этом пациент подвергается только одному оперативному вмешательству и получает одинаковую иммуносупрессивную терапию
Реакция отторжения обычно начинается с лимфоцитарной инфильтрации ацинусов, развития васкулита. Островковая ткань поджелудочной железы некоторое время не изменяется. Лимфоцитарная инфильтрация и повреждение островковой ткани наблюдаются лишь в поздней стадии реакции отторжения. Следовательно, повышение концентрации глюкозы в крови не может служить ранним критерием отторжения, уровень ее повышается только в необратимой стадии реакции отторжения. Изолированное отторжение панкреас без отторжения почки происходит крайне редко. Поэтому ранние признаки отторжения почки (олигурия, повышение креатинина и др.) являются одновременно ранними признаками отторжения поджелудочной железы. При последовательной пересадке панкреас, а затем почки о начале реакции отторжения судят по уровню амилазы в моче, что подтверждает преимущество пересадки панкреас с анастомозом протока железы с мочевым пузырем.
Морфологически отторжение проявляется набуханием трансплантата, размытостью краев пересаженной панкреас, плохой визуализацией ее хвоста при УЗИ. Магнитно-резонансная томография и различные способы УЗИ не позволяют определить отторжение панкреас. Если при пересадке был наложен анастомоз между мочевым пузырем и сегментом двенадцатиперстной кишки, окружающим головку поджелудочной железы, то представляется возможность для проведения биопсии панкреас через цистоскоп.
Побочное действие стероидной терапии
общеизвестно. Обычно оно проявляется синдромом Иценко—Кушинга, медикаментозными угрями, эрозиями, язвой желудка и двенадцатиперстной кишки. В отдаленном периоде у 5—10 % реципиентов может развиться некроз головки бедренной кости, катаракта. При некрозе головки бедренной кости возникает необходимость ее резекции с протезированием одного или обоих тазобедренных суставов. Побочное действие цитостатических препаратов (азатиоприн и др.) проявляется резким угнетением костномозгового кроветворения (лейкопения, тромбоцитопения) и угнетением эритропоэза. Поэтому при проведении цитостатической терапии необходимо постоянно контролировать состояние кроветворной системы и регулировать в соответствии с этим дозировку препаратов. При длительной терапии азатиоприном наблюдается развитие злокачественных опухолей, особенно лимфомы.
В случае передозировки циклоспорина может проявиться его нефротоксическое действие с соответствующим нарушением функции почек, гепатотоксическое действие, ведущее к повышению билирубина и трансаминаз крови. Другие побочные действия циклоспорина (тремор, гирсутизм, гиперплазия десен) сравнительно незначительны. Дискутируется вопрос о возможном повышении риска развития опухолей у лиц, длительно принимавших циклоспорин А.
В отдаленном после операции трансплантации периоде у ряда больных развивается артериальная гипертензия. Она может быть связана с первичным заболеванием почек пациента, существовавшим до пересадки. В этих случаях при неэффективности консервативной терапии приходится осуществлять двустороннюю нефрэктомию. Артериальная гипертензия может развиться также вследствие стеноза почечной артерии (реноваскулярная гипертензия). При хронической сосудистой реакции отторжения трансплантата или при поражении клубочков почки эффективна терапия современными антигипертензивными препаратами. Известно, что артериальная гипертензия является главным фактором риска возникновения хронической ишемической болезни сердца, которая в позднем послетрансплантационном периоде становится наиболее частым заболеванием и причиной смерти.
Успех пересадки почек зависит от иммунологической гистосовместимости. Трансплантаты, взятые от живых доноров (близких родственников), хорошо функционируют у 90—95 % пациентов в течение 1 года и у 85—90 % в течение 2 лет. Трансплантаты от трупов с мозговой смертью, пересаженные в ведущих центрах трансплантации, хорошо функционируют у 70 % в течение первого года и у 60 % на протяжении более 4 лет. Известны сроки выживания больных с пересаженными почками более 20 лет.