воскресенье
Трансплантация печени
Показание м к пересадке печени является терминальная стадия развития цирроза печени, вызванного неумеренным употреблением алкоголя, гепатитом С или В, аутоиммунным гепатитом. Часто показанием к операции является первичная холестатическая болезнь печени, фульминантная печеночная недостаточность, атрезия желчных путей. Значительно реже трансплантацию печени производят при доброкачественных и злокачественных опухолях, у детей — при атрезии желчных путей и некоторых метаболических заболеваниях.
Выбор реципиента. Успешность трансплантации печени зависит от корректного выбора реципиента. Главным является состояние его здоровья к моменту пересадки, способность перенести тяжелую операцию. Реципиент не должен иметь других тяжелых заболеваний в конечной фазе их развития. За 6 мес до операции больной не должен употреблять алкоголя и наркотиков. Операция не показана при наличии внепеченочного онкологического заболевания и не поддающейся излечению инфекции.
Кандидат на пересадку печени должен быть тщательно обследован специалистами разных областей медицины, включая психиатра. До операции необходимо провести лечение имеющихся заболеваний, которые могут повлиять на успешность трансплантации.
Выбор донора. Пересаженная печень должна немедленно выполнять свою синтетическую функцию. В противном случае наступит смерть в ближайшие 72 ч, так как для поддержания ее функции нет никаких устройств, подобных искусственной почке. Нефункционирующую после трансплантации печень удаляют и производят повторную пересадку. Только здоровая печень
1 — нижняя полая вена; 2 — печеночная артерия; 3 — воротная вена; 4 — общий желчный проток (перевязан); 5 — анастомоз желчного пузыря с петлей тонкой кишки; 6 — сегмент печени; 7 — анастомоз желчного протока с петлей тощей кишки; 8 — селезеночная артерия; 9 — селезеночная вена.
донора способна выполнять свою функцию сразу после пересадки. Печень необходимо брать у донора с мозговой смертью и нормально функционирующим сердцем. Трансплантат должен по размерам соответствовать или быть немного меньше печени реципиента. При значительной величине печени донора предпочтение отдают пересадке левой доли (2, 3, иногда 4 сегмента) печени. Трансплантат считается малопригодным, если при биопсии выявляется, что 40 % и более паренхимы печени замещено жиром.
Пересадка сердце—легкие
Успешная трансплантация этих органов единым комплексом была разработана Reitz и сотрудниками. Метод постепенно внедряется в клиники. Основное препятствие — недостаток подходящих доноров.
Показани я к пересадке сердца и легких: 1) первичная легочная гипертензия, синдром Эйзенменгера, 2) кистозный фиброз легких, 3) дефицит а, -антитрипсина.
Выбор донора. Донор по размерам, по возможности, должен соответствовать реципиенту или быть немного меньше, иметь здоровые легкие (по данным рентгенологического исследования), нормальные показатели по газообмену. Естественно, донор должен соответствовать реципиенту по группе крови и по гистосовместимости.
Выбор реципиента. Возраст — не старше 50 лет. В качестве реципиента выбирают пациентов с заболеванием сосудов легких или паренхимы в сочетании с конечной стадией декомпенсации сердца.
У реципиента не должно быть необратимых заболеваний или дисфункции других органов и ранее перенесенных торакотомии или стернотомии.
Операцию начинают так же, как при пересадке сердца. Легкие удаляют поодиночке с помощью сшивающего аппарата, накладываемого на корень легкого. Затем мобилизуют трахею с проксимальными культями бронхов и пересекают ее над кариной. После удаления легких и сердца реципиента подготовленный консервированный трансплантат помещают в грудную полость реципиента и последовательно соединяют швами. Сначала накладывается анастомоз на трахею (бронх при односторонней пересадке), после создания которого легкие начинают вентилировать. Затем накладывают анастомозы между аортой донора и правым предсердием.
Выживаемость после успешной трансплантации сердца и легких такая же, как при пересадке сердца. Иммуносупрессию проводят по тем же правилам. Возможные осложнения — реакция отторжения, кровотечение, обтурирующий бронхолитиаз, который сдерживает широкое распространение метода.
Критерии отбора доноров.
Пересадку сердца выполняют только в отделениях сердечной хирургии, располагающих опытом проведения искусственного кровообращения с холодовой кардиоплегией, где имеются соответствующее оснащение и квалифированный персонал.
Оперативный доступ — срединная стернотомия. После вскрытия перикарда вводят канюли в нижнюю и верхнюю полые вены для подключения аппарата искусственного кровообращения. Продолжительность искусственного кровообращения и холодовой кардиоплегии должна быть возможно короче.
Сердце донора и реципиента иссекают почти полностью, оставляя небольшие участки задних стенок обоих предсердий (места впадения полых вен в правое предсердие и место впадения легочных артерий в левое предсердие). После осмотра подготовленного соответствующим образом сердца донора его соединяют швами с оставшейся задней стенкой левого предсердия, перегородкой между ними, остатком правого предсердия, аортой и легочной артерией реципиента. После снятия зажима с аорты принимают меры для скорейшего восстановления сокращений сердца, если оно не восстанавливается самостоятельно.
Иммуносупрессию проводят по общим правилам. В последние годы в схему иммуносупрессии включают моноклональные антитела (ОКТЗ и др.). В течение первого года после операции выживает около 80 % пациентов, после 5 лет — около 64 % и после 10 лет и более — 45 %.
Реакция отторжения проявляется аритмией, гипотензией, повышением температуры, слабостью, нехваткой воздуха. ЭКГ недостаточно информативна. Для выявления ранних признаков реакции отторжения используют чрезвенозную эндокардиальную биопсию миокарда с последующим изучением его гистологической структуры. Рутинно используют также радиоизотопную вентрикулографию, которая позволяет следить за реакцией отторжения и изменениями в процессе лечения иммуносупрессантами.
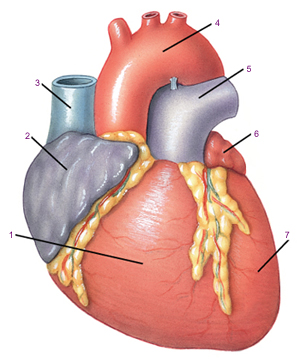
Трансплантация сердца
а — общий вид после удаления сердца реципиента; б — вид после завершения операции трансплантации. 1 — нижняя полая вена; 2 — верхняя полая вена; 3 — аорта; 4 — легочная артерия; 5 — задняя стенка левого предсердия; 6 — задняя стенка правого предсердия (реципиента); 6 — правое предсердие донорского сердца; 7 — пересаженное донорское сердце.
Показаниям и к трансплантации сердца являются хроническая ишемическая болезнь сердца в терминальной стадии развития болезни (около 45 % всех трансплантаций сердца), кардиомиопатия с явлениями выраженной сердечной недостаточности (45 %), тяжелые комбинированные пороки сердца, значительно реже — другие виды заболеваний сердца.
Критериями отбора реципиентов для трансплантации сердца являются:
1) сердечная недостаточность IV степени по классификации Нью-Йоркской ассоциации кардиологов или предполагаемая продолжительность жизни пациента менее 6 мес;
2) возраст реципиента — от периода новорожденное™ до 60 лет (в некоторых центрах до 65 лет);
3) удовлетворительное состояние пациента до появления признаков конечной стадии развития сердечного заболевания; у реципиента должна быть нормальная функция или легко обратимая, временная дисфункция легких, печени, почек, ЦНС, а также эмоциональная стабильность и коммуникабельность;
4) резистентность легочных сосудов должна быть нормальной или поддающейся фармакологической коррекции;
5) у реципиента не должно быть активно развивающейся инфекции или онкологического процесса, недавно перенесенной тромбоэмболии легочной артерии, тяжелого сосудистого заболевания.
При выборе метода лечения врач должен быть уверен в том, что пересадка сердца является единственным способом продлить жизнь больного, что все возможности других методов лечения тяжелого сердечного заболевания исчерпаны.
Противопоказаниями к трансплантации сердца являются: 1) системные заболевания (например, инсулинзависимый сахарный диабет, не поддающиеся коррекции хронические заболевания почек, ЦНС, психические заболевания, активная инфекция в организме); 2) высокое давление в системе легочной артерии (легочная гипертензия); 3) выраженное ожирение, алкоголизм или наркомания.
Иммуносупрессивная терапия
После успешной пересадки поджелудочной железы углеводный обмен нормализуется, пациент избавляется от необходимости вводить инсулин, но зато должен принимать иммуносупрессивные препараты. Основная цель одновременной пересадки панкреас и почки заключается в том, чтобы остановить прогрессирование нефропатии, ретинопатии, нейропатии. Как правило, это удается достичь, качество жизни пациентов становится намного лучше по сравнению с жизнью на фоне гемодиализа.
Теоретически можно добиться нормогликемии путем трансплантации клеток островков Лангерганса, практически — крайне трудно. Для этого необходимо измельчить панкреас донора, подвергнуть смесь клеток воздействию коллагеназы и затем отцентрифугировать клетки островков Лангерганса на специальной центрифуге. Из одной панкреатической железы удается получить очень мало жизнеспособных клеток для введения их в портальную вену, в ткань селезенки или под капсулу почки. Эта методика находится в начальной стадии разработки. Делаются попытки пересадки поджелудочной железы от 16—20-недельного эмбриона. Его размер едва достигает 0,5 см, а масса поджелудочной железы 10—20 мг. Железа способна расти и выделять инсулин в течение непродолжительного времени. В мире сделано около 200 экспериментальных пересадок эмбриональной поджелудочной железы с очень ограниченным успехом.
Трансплантация поджелудочной железы
Показани я к пересадке поджелудочной железы являются противоречивыми. Не вызывает сомнения, что пересадка должна быть произведена до появления тяжелых или необратимых осложнений сахарного диабета, таких как тяжелая ретинопатия, угрожающая слепотой, нейропатия, нефропатия, тяжелое заболевание микрососудов и крупных стволов.
Противопоказани я к трансплантации поджелудочной железы такие же, как к трансплантации почки и других органов. Особенно тщательно должно быть исследовано сердце реципиента. В связи с нейропатией многие пациенты не ощущают стенокардию даже при значительном поражении коронарных сосудов. Для уточнения диагноза рекомендуется провести радиоизотопное исследование сердца, ангиографию коронарных сосудов.
Выбор донора и изъятие поджелудочной железы имеют большое значение для успеха трансплантации. Поджелудочную железу берут обычно у молодого, здорового донора с мозговой смертью. Возраст донора может колебаться от 3 до 55 лет. У взрослых доноров необходимо исключить атеросклеротическое поражение чревного ствола. Абсолютным противопоказание м для изъятия поджелудочной железы у донора является инфекция в брюшной полости, травма железы, острый панкреатит и наличие диабета у донора. Содержание глюкозы и амилазы в крови донора не отражает состояние и пригодность поджелудочной железы для трансплантации. Панкреас изымают вместе с печенью и двенадцатиперстной кишкой или отдельно. После изъятия органов печень отделяют от поджелудочной железы. Последнюю консервируют в специальном растворе (Виспан, ДюПонт) и сохраняют в контейнере при низкой температуре до момента пересадки. Максимальный срок хранения консервированного органа 20—30 ч.
Для пересадки используется либо сегмент (хвост и тело), либо вся поджелудочная железа вместе с сегментом двенадцатиперстной кишки. Существуют различные мнения по поводу отведения экзокринного сока. Выводной проток панкреас может быть перевязан, блокирован специальным полимером или оставлен открытым (тогда панкреатический сок выделяется в свободную брюшную полость), соединен соустьем с изолированной по Ру петлей тонкой кишки, мочевым пузырем или мочеточником.
При пересадке целой поджелудочной железы вместе с сегментом двенадцатиперстной кишки последний соединяют анастомозом бок в бок с тонкой кишкой или мочевым пузырем. При пересадке сегмента поджелудочной железы выводной проток ее чаще блокируют неопреном или другим быстро отвердевающим синтетическим материалом. Однако эта методика менее популярна по сравнению с отведением панкреатического сока в кишку или мочевой пузырь. При отведении панкреатического сока в мочевой пузырь уменьшается опасность инфекции, появляется возможность контролировать содержание амилазы в моче и судить о начинающейся реакции отторжения и функциональном состоянии трансплантата, поэтому эту методику часто используют в ряде центров. Недостатком соединения протока железы с мочевым пузырем является потеря большого количества бикарбонатов с панкреатическим соком, развитие ацидоза, гематурии, инфекции мочевого пузыря, стриктуры уретры.
Поджелудочную железу, как и почку, пересаживают в подвздошную ямку. При этом последовательно соединяют вены, артерии, выводной проток железы. Принято три варианта пересадки поджелудочной железы: пересадка только железы (у больных
в преуремическом состоянии), почки, а потом поджелудочной железы. Кажущееся преимущество послепочка.
довательной пересадки состоит в том, что панкреас пересаживают на фоне иммуносупрессивной терапии, проводимой по поводу пересаженной ранее почки. Однако результаты последовательной пересадки оказались хуже одновременной пересадки почки и поджелудочной железы. Поэтому в большинстве случаев теперь производят одновременную пересадку обоих органов.
При этом пациент подвергается только одному оперативному вмешательству и получает одинаковую иммуносупрессивную терапию
Реакция отторжения обычно начинается с лимфоцитарной инфильтрации ацинусов, развития васкулита. Островковая ткань поджелудочной железы некоторое время не изменяется. Лимфоцитарная инфильтрация и повреждение островковой ткани наблюдаются лишь в поздней стадии реакции отторжения. Следовательно, повышение концентрации глюкозы в крови не может служить ранним критерием отторжения, уровень ее повышается только в необратимой стадии реакции отторжения. Изолированное отторжение панкреас без отторжения почки происходит крайне редко. Поэтому ранние признаки отторжения почки (олигурия, повышение креатинина и др.) являются одновременно ранними признаками отторжения поджелудочной железы. При последовательной пересадке панкреас, а затем почки о начале реакции отторжения судят по уровню амилазы в моче, что подтверждает преимущество пересадки панкреас с анастомозом протока железы с мочевым пузырем.
Морфологически отторжение проявляется набуханием трансплантата, размытостью краев пересаженной панкреас, плохой визуализацией ее хвоста при УЗИ. Магнитно-резонансная томография и различные способы УЗИ не позволяют определить отторжение панкреас. Если при пересадке был наложен анастомоз между мочевым пузырем и сегментом двенадцатиперстной кишки, окружающим головку поджелудочной железы, то представляется возможность для проведения биопсии панкреас через цистоскоп.
Побочное действие стероидной терапии
общеизвестно. Обычно оно проявляется синдромом Иценко—Кушинга, медикаментозными угрями, эрозиями, язвой желудка и двенадцатиперстной кишки. В отдаленном периоде у 5—10 % реципиентов может развиться некроз головки бедренной кости, катаракта. При некрозе головки бедренной кости возникает необходимость ее резекции с протезированием одного или обоих тазобедренных суставов. Побочное действие цитостатических препаратов (азатиоприн и др.) проявляется резким угнетением костномозгового кроветворения (лейкопения, тромбоцитопения) и угнетением эритропоэза. Поэтому при проведении цитостатической терапии необходимо постоянно контролировать состояние кроветворной системы и регулировать в соответствии с этим дозировку препаратов. При длительной терапии азатиоприном наблюдается развитие злокачественных опухолей, особенно лимфомы.
В случае передозировки циклоспорина может проявиться его нефротоксическое действие с соответствующим нарушением функции почек, гепатотоксическое действие, ведущее к повышению билирубина и трансаминаз крови. Другие побочные действия циклоспорина (тремор, гирсутизм, гиперплазия десен) сравнительно незначительны. Дискутируется вопрос о возможном повышении риска развития опухолей у лиц, длительно принимавших циклоспорин А.
В отдаленном после операции трансплантации периоде у ряда больных развивается артериальная гипертензия. Она может быть связана с первичным заболеванием почек пациента, существовавшим до пересадки. В этих случаях при неэффективности консервативной терапии приходится осуществлять двустороннюю нефрэктомию. Артериальная гипертензия может развиться также вследствие стеноза почечной артерии (реноваскулярная гипертензия). При хронической сосудистой реакции отторжения трансплантата или при поражении клубочков почки эффективна терапия современными антигипертензивными препаратами. Известно, что артериальная гипертензия является главным фактором риска возникновения хронической ишемической болезни сердца, которая в позднем послетрансплантационном периоде становится наиболее частым заболеванием и причиной смерти.
Успех пересадки почек зависит от иммунологической гистосовместимости. Трансплантаты, взятые от живых доноров (близких родственников), хорошо функционируют у 90—95 % пациентов в течение 1 года и у 85—90 % в течение 2 лет. Трансплантаты от трупов с мозговой смертью, пересаженные в ведущих центрах трансплантации, хорошо функционируют у 70 % в течение первого года и у 60 % на протяжении более 4 лет. Известны сроки выживания больных с пересаженными почками более 20 лет.
Хроническая реакция отторжения
начинается спустя 3— 4 нед после операции трансплантации. Причиной ее является распространенное облитерирующее поражение сосудов почки. Вследствие резкого сужения просвета сосудов нарушается кровоснабжение пересаженной почки, уменьшается клубочковая фильтрация, нарастает азотемия. Хроническая сосудистая реакция отторжения трансплантата является наиболее частой причиной утраты функции пересаженной почки. Усиление иммунодепрессивной терапии обычно малоэффективно, постепенно почка погибает, возникает необходимость в ее удалении, переводе больного на гемодиализ и в повторной пересадке почки. Некоторым больным пересадку почки приходится повторять несколько раз.
Осложнения иммунодепрессивного лечения. Основой успешного исхода пересадки почки, помимо соблюдения принципов гистосовместимости и хирургической техники, является иммунодепрессивная терапия. Угнетая иммунную защитную реакцию организма против пересаженного органа, иммунодепрессивная терапия одновременно угнетает механизмы защиты против инфекции. Инфекционные осложнения (чаще в мочевых путях и в ране) наблюдаются почти у 90 % реципиентов. Они сравнительно легко поддаются лечению антибактериальными препаратами. Наиболее опасно нагноение в ложе трансплантированной почки вблизи крупных сосудов в связи с угрозой массивного кровотечения и развития сепсиса. Поэтому необходимо тщательное соблюдение правил асептики и антисептики не только во время операции, но и на протяжении всего послеоперационного периода при уходе за больным (смене повязок, катетеров, дренажей и т. п.). Профилактическое введение антибиотиков малообоснованно, их необходимо вводить при появлении ранних признаков инфекции.
Наряду с банальной хирургической инфекцией для больного опасны также вирусная, особенно цитомегаловирусная, инфекция и вирусы, вызывающие герпес. Цитомегаловирусная инфекция может быть внесена в организм реципиента вместе с трансплантированной почкой. Течение этого вида инфекции обычно очень тяжелое, угрожающее жизни пациента. При появлении первых признаков заболевания необходимо уменьшить иммунодепрессивную терапию, ввести цитомегаловирусный гипериммунный глобулин.
Сверхострое отторжение
наступает через несколько минут или часов после трансплантации. Почка приобретает синюшный цвет, кровообращение в ней прекращается, моча перестает выделяться, почка погибает. Гистологически обнаруживают распространенное отложение фибрина и тромбоцитов в сосудах, скопление в клубочках и перитубулярных сосудах нейтрофилов, тромбоцитов, эритроцитов и фибрина. Сверхострое отторжение не поддается лечению иммунодепрессантами.
Острый криз отторжения обычно возникает с 4-го дня после трансплантации и может возникать повторно в течение нескольких месяцев и даже нескольких лет. При гистологическом исследовании выявляют интерстициальный нефрит. В трансплантате обнаруживают лимфоцитарную инфильтрацию (иммунокомпетентные клетки реципиента) паренхимы, отек ткани. В связи с отеком почка увеличивается вплоть до надрыва капсулы и паренхимы с последующим кровотечением. В области пересаженной почки появляется локальная болезненность, повышается температура тела, развивается слабость, стойкая гипертензия. Появляется олигурия, нарастает азотемия (повышается креатинин и мочевина крови). Эти симптомы редко выявляются у реципиентов, получающих циклоспорин. У реципиентов, получавших циклоспорин А, не наблюдается набухания пересаженной почки, не повышается температура и лишь олигурия или анурия свидетельствует о реакции отторжения, которая может быть подтверждена изучением перфузии почки радиоизотопным методом. Для уточнения диагноза производят биопсию почки. При ультразвуковом исследовании обнаруживается увеличение размеров пересаженной почки, толщины ее коркового слоя.
Гистологическое исследование в раннем периоде позволяет выявить прилипание лимфоцитов к эндотелию перитубулярных капилляров и венул. Значительное скопление их приводит к разрыву этих сосудов, некрозу извитых канальцев и интерстициальным инфильтратам. Клеточные инфильтраты образованы мелкими лимфоцитами. Позднее в инфильтрате появляются крупные лимфоциты и макрофаги. Если процесс отторжения приближается к необратимому, наблюдается набухание интимы и очаговый фибриноидный некроз медиа, заканчивающийся пролиферацией эндотелиальных клеток и облитерацией просвета мелких артерий фибрином, тромбоцитами, лимфоидными клетками. Для уточнения диагноза острого отторжения производят транскутанную биопсию почки. Как только установлен диагноз, немедленно приступают к лечению иммунодепрессантами (стероидные гормоны, ОКТЗ, антилимфоцитарная сыворотка и др.).
В случае правильного лечения интерстициальный нефрит пересаженной почки полностью исчезает. Однако если лечение начато поздно или доза иммунодепрессантных препаратов неадекватна, то острая реакция отторжения может привести к необратимым изменениям в трансплантированной почке, ее гибели и отторжению.
Трансплантация почек
В мире наиболее часто производят трансплантацию почек (до 50 % всех пересадок органов). Показание м к пересадке почки является терминальная стадия хронической почечной недостаточности, вызванная хроническим гломерулонефритом или инсулинзависимым диабетом. Другими важными показаниями являются поликистоз почек, гипертензивный нефросклероз, системная красная волчанка, нефросклероз, пиелонефрит.
Кандидатами на пересадку почки являются молодые пациенты, у которых хроническая почечная недостаточность не связана с системным заболеванием, которое может повредить трансплантированную почку. Показания к пересадке почек расширяются в связи с неоспоримым преимуществом ее перед хроническим гемодиализом. Качество жизни пациента после трансплантации почки несомненно выше по сравнению с пациентом, находящимся на хроническом диализе. В срочной пересадке почки нуждаются дети и юноши с хронической почечной недостаточностью, физическое и психическое развитие которых замедляется в связи с гемодиализом.
Пересадка почки абсолютно противопоказан а пациентам с активной инфекцией и злокачественными заболеваниями, которые не могут быть устранены до операции, потому что применение иммуносупрессивной терапии вызовет обострение обоих заболеваний. Пожилой возраст, серьезные сердечно-сосудистые и тяжелые сопутствующие заболевания препятствуют трансплантации почек. Относительным противопоказанием является недостаточная коммуникабельность потенциального реципиента, отсутствие готовности к взаимодействию с врачом в процессе лечения (психические заболевания, наркомания, алкоголизм и др.). Реципиент должен быть тщательно обследован с применением клинических, инструментальных и лабораторных методов. Необходимо определить AB0 и титрование HLA на гистосовместимость.
Наилучшие результаты трансплантации почки наблюдаются в случаях, когда реципиент и живой родственный донор имеют идентичные HLA-антигены. Риск для живого донора во время нефрэктомии практически минимальный, оставшаяся почка умеренно гипертрофируется и полностью компенсирует функцию удаленной. Взятие почки от платного донора запрещено законом. Почка мертвого донора с мозговой смертью при строгом соблюдении всех правил подбора по гистосовместимости приживает хорошо при правильно спланированной иммуносупрессивной терапии.
Донорскую почку обычно пересаживают в подвздошную ямку (гетеротопическая пересадка) внебрюшинно. У детей, которым пересаживают почку взрослого, из-за больших размеров органа используют чрезбрюшинный доступ, помещая почку в поясничную область. Сосуды почки сшивают с наружными подвздошными артерией и веной. Косо срезанный мочеточник имплантируют в мочевой пузырь. Сначала соединяют почечную и подвздошную вены по типу конец в бок, затем по такому же типу соединяют почечную и подвздошную артерии, в последнюю очередь накладывают анастомоз между мочеточником и мочевым пузырем.
Функция почки в большинстве случаев восстанавливается сразу после наложения анастомозов, однако нормализация ее деятельности происходит в течение нескольких дней, а явления почечной недостаточности исчезают спустя несколько недель, поэтому в послеоперационном периоде приходится проводить несколько сеансов гемодиализа. Иммуносупрессивную терапию проводят в соответствии с общими правилами по одной из имеющихся схем.
Осложнения в раннем послеоперационном периоде. К ним относятся кровотечение, несостоятельность анастомоза мочеточника с мочевым пузырем и образование мочевых свищей, инфицирование раны и ложа почки. Могут возникнуть и такие осложнения, как острая недостаточность трансплантата, реакция отторжения трансплантата, и осложнения, связанные с применением иммунодепрессивной терапии.
Временное отсутствие функции трансплантата наблюдается у 10—15 % реципиентов. Оно обычно обусловлено развитием грубой дистрофии или некроза эпителия извитых канальцев пересаженной почки вследствие ишемии и гипоксии ее до и во время взятия или последующего хранения до момента пересадки. В результате у больного развивается олигурия или анурия. Функция трансплантированной почки обычно восстанавливается в течение 2-й недели. Для удаления азотистых продуктов обмена в течение этого периода больному проводят гемодиализ. Причиной олигурии и анурии может быть также тромбоз сосудистых анастомозов, обструкция мочеточника, сдавление пересаженной почки мочевым затеком.
Реакция отторжения трансплантата оказывает большое влияние на клиническое течение в послеоперационном периоде.
Иммунодепрессия
Реакция иммунной системы различна не только у разных лиц, но и у одного и того же индивидуума. При пересадке почек у некоторых пациентов не возникает никакой защитной реакции, в то время как у других отторгаются два и более последовательно пересаженных органа, несмотря на попытки подавить реакцию отторжения. Причина такого явления до настоящего времени остается неясной. Известно также, что неоднократное переливание крови (от трех и более доноров) перед операцией трансплантации почек улучшает приживление трансплантата. Прогноз приживления трансплантата менее благоприятен у лиц, не подвергавшихся воздействию антигенов ни при переливании крови, ни при беременности. Поэтому потенциальным реципиентам для пересадки почки в некоторых центрах систематически производят переливания крови. Число переливаний и время их выполнения различны. Объяснения причины этого феномена пока нет.
Приживление аллогенного трансплантата (органа) может быть значительно улучшено применением лекарственных средств, подавляющих иммунную реакцию отторжения органа, так называемых иммуносупрессантов.
Для иммуносупрессивной терапии в большинстве центров трансплантации органов применяют тройную комбинацию препаратов (циклоспорин А, или такролимус (FK-506), преднизолон, азатиоприн), обладающих разным механизмом действия на иммунную систему. Такролимус (FK-506) и циклоспорин, близкие друг к другу по механизму действия, обладают сильным нефротоксическим действием, поэтому требуют тщательного подбора дозы. Комбинация нескольких препаратов позволяет уменьшить дозировку и токсическое действие каждого из них.
Кортикостероиды истощают запас лимфоцитов в циркулирующей крови путем их разрушения. Аналогичное действие оказывает такролимус (FK506), антилимфатическая сыворотка. Циклоспорин А блокирует антигенспецифическую дифференцировку Т-лимфоцитов, их активацию как клеток-эффекторов. Аналогичное действие оказывает препарат FK-506. Эти препараты позволяют прервать раннюю активацию Т-лимфоцитов и продукцию цитокинов, имеющих решающее значение для последующего каскада иммунной реакции, которая в конечном итоге приводит к отторжению трансплантированного органа.
Ингибиторы метболизма (например, азатиоприн) угнетают пролиферацию лимфоцитов. В последние годы стали использовать моноклональные антитела против цитокинов, в частности против 1L-2. Функцию периферических лимфоцитов или Т-лимфоцитов подавляют также антилимфоцитарный и антитимоцитарный глобулины.
Кризы отторжения обычно подавляют с помощью увеличения дозы стероидных гормонов до 100—1000 мг в сутки или дополнительного введения антилимфоцитарных и антитимоцитарных глобулинов, анти-ИЛ-2 антител и антицитокиновых антител.
Иммунодепрессивные средства, подавляя иммунные механизмы защиты реципиента, могут способствовать появлению побочных реакций — снижению иммунной защиты против инфекций (в том числе вирусной, грибковой), возможному повышению риска раковых заболеваний, появлению синдрома Иценко—Кушинга и других осложнений стероидной терапии (язва желудка и двенадцатиперстной кишки, кровотечение, перфорация язв, гипертензия, панкреатит, катаракта и др.).
Моноклональные антитела против 1L-2 или против цитокинов воздействуют лишь на отдельные звенья реакции отторжения, в меньшей степени угнетают иммунную систему и защиту организма от инфекции и других осложнений иммуносупрессивной терапии.
Реакция отторжения пересаженного органа
Реакция может произойти в различные сроки после операции даже при совместимости тканей по АВО-группам крови и системе HLA-антигенов I класса, так как существует еще ряд локусов, по которым не достигнута совместимость тканей донора и реципиента. Эту реакцию вызывают HLA-антигены гистосовместимости клеток пересаженного органа, против которых вырабатываются антитела. По степени выраженности различают сверхострую, острую и хроническую реакции отторжения.
Сверхострая реакция отторжения развивается в течение нескольких минут или часов после пересадки органа. Она обусловлена наличием антиHLA-антител в организме реципиента, появившихся до пересадки органа, и обычно не поддается лечению. В этом случае трансплантат погибает в течение 24 ч.
Острая реакция отторжения протекает по типу криза отторжения, обусловленного клеточной иммунной реакцией Т-лимфоцитов и сывороточными анти-НЬА-антителами с 4-го дня после операции (чаще через 4 нед и позднее). Для Т-лимфоцитов первичной мишенью для распознавания чужих HLA-антигенов и деструкции клеток являются антигены, расположенные на поверхности клеток. Острая реакция отторжения достаточно хорошо поддается терапевтическому иммуносупрессивному воздействию.
Хроническая реакция отторжения развивается медленно, через несколько недель, месяцев и лет после операции, может несколько раз рецидивировать после подавления ее иммуносупрессивной терапией Она обусловлена, так же как и острая реакция отторжения, клеточными иммунными механизмами и гуморальными антителами, появившимися в ответ на трансплантацию, и поддается терапевтическому лечению. Следы реакции отторжения можно обнаружить в пересаженном органе при гистологическом исследовании даже в случае гладкого клинического течения послеоперационного периода.
Реакции отторжения трансплантата, вызванные клеточными механизмами защиты, проявляются в виде интерстициального воспаления, заканчивающегося некрозом клеток и образованием рубцовой ткани. Реакции отторжения, вызванные сосудистыми механизмами защиты, приводят при пересадке почек и сердца к облитерируюшему заболеванию сосудов трансплантированного органа, которое резко ухудшает его кровоснабжение, а в экстремальных случаях вызывает некроз трансплантата.
Лимфоцитотоксический тест
применяют для определения HLA I и II классов. Исследуемую суспензию лимфоцитов смешивают и инкубируют с набором анти-НЬА-антисывороток известной специфичности. Если антисыворотка содержит антитела к одному из HLA-антигенов, то они связываются с клеточной мембраной. Затем добавляют комплемент и продолжают инкубировать. Клетки, несущие на мембране связанные антитела, будут разрушены при активации комплемента. Затем добавляют краситель (эозин или трипановый синий). Краситель поглощается только мертвыми клетками, которые окрашиваются. Живые клетки отторгают краситель. Это позволяет установить HLA-антиген по антисыворотке, вызвавшей лизис.
При этой пробе выявляются только серологически дефинированные (SD) HLA-антигены, которые представляют не весь спектр антигенов гистосовместимости, а только те из них, которые продуцируют антитела. Некоторые варианты HLA-антигенов не обладают иммуногенностью, а некоторые иммуногенные не продуцируют антитела. В этих случаях для их дифференцирования применяют последовательный (секвенциальный) анализ ДНК или РНК.
Для идентификации антигенов гистосовместимости II класса, кодируемых генами HLA-DR, применяют клеточную реакцию (реакцию бласттрансформации). При этой пробе взвесь лимфоцитов реципиента смешивают с лимфоцитами донора. При отсутствии совместимости лимфоциты реципиента подвергаются пролиферации и образуют бластные формы. Антигены II класса главного комплекса гистосовместимости активируют и стимулируют пролиферацию Т-хелперов, способных выявлять разницу в антигенах, что недоступно при проведении серологических тестов.
В хорошо оснащенных лабораториях совместимость определяют методом цитофлоуметрии или усовершенствованным методом анализа ДНК. Серологическое HLA-типирование бывает некорректным в 25 % случаев. Более точные результаты дает секвенциальный анализ DR ДНК с помощью специального набора реактивов фирмы "Gen Irak".
Клеточная реакция против несовместимых HLA-антигенов зависит от Т-лимфоцитов. Т-хелперы распознают антигены класса II, Т-цитотоксические лимфоциты распознают класс I, а Т-супрессоры способствуют приживлению трансплантата.
Реакция отторжения аллотрансплантата является комплексной, сложной, зависящей от цитодеструктивного действия активированных лимфоцитов — Т-хелперов, Т-цитотоксических, В-лимфоцитов, анти-HLA-антител и активированных макрофагов. Активация Т-хелперов антигенами II класса стимулирует выработку ряда факторов, включая интерлейкин(ИЛ)-2, являющийся одним из главных факторов роста лимфоцитов, выполняющих основную роль в отторжении трансплантата.
Цитотоксические Т-лимфоциты, стимулированные антигенами I класса, продуцируют IL-2-рецепторы. Затем IL-2 взаимодействует со специфическими ИЛ-2-рецепторами на поверхности чужеродных клеток и разрушает их. Стимулированные макрофаги и другие клетки продуцируют IL-1, который в свою очередь стимулирует продукцию IL-2.
В реакции отторжения важную роль играет и гуморальная реакция, особенно на антигены I класса. Реципиенты с первичной иммунной реакцией против антигенов I класса, проявляющейся присутствием цитотоксических анти-HLA-антител в сыворотке, реагируют избыточной продуцией цитотоксических антител при встрече (взаимодействии) с аналогичными антигенами. Присутствие цитотоксических анти-HLA-антител у реципиента до трансплантации при наличии в донорском трансплантате антигенов, против которых в организме реципиента имеются антитела, реализуется немедленной (сверхострой) деструктивной реакцией отторожения, обусловленной фиксацией антител на донорском эндотелии. В результате тромбоцитарные и фибринозные сгустки откладываются в сосудах донорского органа, возникает тромбоз и ишемический некроз трасплантата.
Иммунологические основы пересадки органов
Известно, что иммунная система защищает организм не только от инфекции. Одной из важнейших ее функций является распознавание чужеродных антигенов и уничтожение генетически чуждых данному организму клеток. Поэтому наиболее успешное приживление пересаженного органа возможно только в случае генетической близости тканей донора и реципиента, т. е. при изогенной трансплантации. При пересадке органа от другого организма того же вида (аллогенная трансплантация) всегда необходимо определять совместимость по группе крови (АВО-антигены) и антигенам гистосовместимости HLA-системы, расположенной в главном комплексе гистосовместимости (major histocompatibility complex). Он представляет собой хромосомный комплекс тесно связанных генов, составляющих код антигенов, отвечающих за гистосовместимость. Главный комплекс гистосовместимости расположен в коротком сегменте шестой хромосомы. HLA-система включает по меньшей мере семь локусов: HLA-A, HLA-B, HLA-C, HLA-D, HLA-DR, HLA-DQ, HLA-DP. Каждый локус в высшей степени полиморфный, контролирует от 8 до 50 антигенов. Генетический термин "гаплотип" имеет отношение к наследованию всех генов HLA-региона в одной хромосоме. Номенклатуру генов в системе HLA-комплекса определяет номенклатурный комитет ВОЗ и публикует в специальном издании "Номенклатура факторов HLA-системы".
Антигены гистосовместимости подразделяют в соответствии с их функцией и биохимическим строением на классы: I класс антигенов находится в HLA-локусах А, В и С; II класс — в локусах D и DR. Антигены I и II классов по-разному распределены в клетках. Антигены I класса имеются во всех ядросодержащих клетках организма, включая Т- и В-лимфоциты и тромбоциты. Антигены II класса имеются на В-лимфоцитах, моноцитах, макрофагах, на некоторых типах эндотелиальных клеток и на активированных Т-лимфоцитах.
Трансплантация органов с определением совместимости донорского органа с реципиентом по эритроцитарным и лейкоцитарным (HLA) антигенам позволила сделать еще один значительный шаг на пути улучшения приживляемое™ пересаженных органов.
Тесты на гистосовместимость имеют первостепенное значение для поиска HLA-идентичных близнецов. Только одна четвертая часть трансплантатов, взятых от братьев и сестер, являются гаплоидидентичными, совпадающими по шести главным HLA-антигенам (парные А, В и DR), без учета "малых" локусов гистосовместимости. Указанные тесты имеют меньшее значение при подборе доноров из родственников или доноров, не имеющих родственных связей. HLA-генетическая система очень полиморфна и едва ли можно найти подходящего по всем критериям неродственного донора. Иногда удается выявить совпадение по большинству и даже по 6 главным HLAантигенам (по А-, В- и DR-локусам) с лучшими шансами на выживание трансплантата.
В крови пациентов, имевших несколько беременностей, неоднократные трансфузии крови или трансплантации, появляются антитела против HLA-антигенов гистосовместимости как реакция на воздействие чужих клеток, с другим набором HLA. При новой встрече HLA-антигенов донора с имеющимися у реципиента преформированными aHTH-HLA-антителами выработка преформированных антител резко увеличивается. Реакция антиген—антитело происходит немедленно, бурно. В результате возникает неподдающаяся лечению сверхострая реакция отторжения пересаженного органа.
Для того чтобы выявить наличие у реципиента анти-HLA-антитела против HLA-антигенов донорских клеток производят перекрестную пробу на гистосовместимость. Для проведения теста донорские лимфоциты, меченные мСг, смешивают с сывороткой и комплементом реципиента и подвергают инкубации. Если донорские клетки будут убиты, о чем свидетельствует выделение свободного хрома-51, перекрестную пробу считают положительной. В этом случае донорский орган несовместим с реципиентом. Неизбежно возникнет сверхострая реакция отторжения.
Оптимальным вариантом для пересадки
является наличие здорового донора, в возрасте от 3 до 65 лет, с необратимой по тяжести травмой головы или неизлечимыми цереброваскулярными заболеваниями. При крайнем недостатке донорских органов в некоторых странах разрешается использовать органы от лиц с мозговой смертью старше 65 лет или от доноров с биологической смертью (с несокращающимся сердцем). Должны быть выяснены анамнестические данные донора и проведено тщательное физикальное, лабораторное и инструментальное обследование, чтобы выявить заболевания, которые являются противопоказанием к взятию донорских органов. К их числу относятся генерализованная инфекция (включая скрытые формы ВИЧ-инфекции, вирусного гепатита В и С), опухоли (за исключением неметастазирующих опухолей мозга). Гипертония и атеросклероз не являются противопоказанием к взятию органов.
Смерть мозга устанавливается комиссией, состоящей из анестезиолога, хирурга (нейрохирурга), невропатолога, психиатра и лечащего врача, по установленным неврологическим критериям, после двукратного обследования в стационаре с интервалом от 6 до 12 ч. Утрата функций мозга определяется:
1) по отсутствию реакции на внешние болевые раздражители, наличию глубокой комы, атонии мышц;
2) по отсутствию самостоятельного дыхания и кашлевого рефлекса (в том числе при изменении положения эндотрахеальной трубки или отсутствию раздражения слизистой оболочки трахеи и бронхов при отсасывании мокроты), спонтанных дыхательных движений в течение 3 мин после отключения аппарата искусственного дыхания;
3) по отсутствию движений глаз, корнеальных рефлексов, реакции зрачков на свет, наличию широких зрачков, изоэлектрической ЭЭГ (отсутствие активности мозга);
4) по неуклонному снижению температуры тела. Постепенно развившуюся гипотермию с температурой тела ниже 32 °С можно считать надежным критерием мозговой смерти;
5) по снижению кровяного давления, несмотря на проводимые реанимационные мероприятия (трансфузия растворов и введение лекарственных средств в течение многих часов).
При малейшем сомнении рекомендуется произвести электроэнцефалографию или ангиографию мозга, чтобы убедиться в отсутствии кровообращения в нем. В случае мозговой смерти введение атропина не вызывает изменения сердечного ритма.
Решение о смерти мозга нельзя принимать, если пациент находится в глубокой гипотермии, выраженной гиповолемии, при отеке мозга, в состоянии интоксикации депрессантами, подобными барбитуратам, потому что при этих состояниях может наблюдаться обратимая изоэлектрическая электроэнцефалограмма. i
Врачи из бригады трансплантологов не должны принимать участия в установлении диагноза смерти мозга. Правила констатации факта смерти мозга, неврологические критерии и процедура взятия органов от донора в нашей стране юридически узаконены. Если умерший при жизни не оставил завещания о согласии на изъятие органов, то в случае его внезапной мозговой смерти для изъятия органов требуется согласие родственников. Взятие органов для трансплантации осуществляет специальная бригада врачей в том же лечебном учреждении, где произошла смерть.
После установления смерти мозга решающим для сохранения жизнеспособности органов, функционально пригодных для трансплантации, является поддержание кровообращения и дыхания в организме донора на оптимальном уровне до момента изъятия органов. Это позволяет предотвратить гибель донорских органов от тепловой ишемии. Переносимость тепловой ишемии для разных органов различна: для почки — максимально 45 мин, для печени и сердца — 20 мин, для поджелудочной железы — 30 мин.
При нестабильном кровообращении у доноров с сохранившейся сердечной деятельностью с целью сохранения жизнеспособности органов, до их изъятия, рекомендуется произвести консервацию тела донора. Для этого сосудистую систему с помощью специальных артериального и венозного катетеров, подключенных к перфузионному аппарату, отмывают от крови. Затем производят постоянную перфузию организма через бедренные артерии и вену специальным изоосмолярным или гиперосмолярным раствором ЕвроКоллинз при температуре +4 °С. Из тела охлажденного, законсервированного донора, по возможности, берут для пересадки все органы, необходимые в данный момент центру трансплантации.
Время холодовой ишемии, т. е. время от момента охлаждения органа до его трансплантации, также ограничено. Чем короче время тепловой и холодовой ишемии органа, тем лучше сохраняется его жизнеспособность.
В Европе имеется специальная организация (Евротрансплантат), которая ведет картотеку лиц, ожидающих трансплантацию, с указанием группы крови и данными типирования тканей, помогает в подборе наиболее подходящего донорского органа по критериям гистосовместимости и транспортировке. В нашей стране эту функцию выполняет Научно-исследовательский институт трансплантологии и искусственных органов.
Консервация органа, взятого у донора, сохранение его функциональной жизнеспособности является важным звеном, обеспечивающим успех трансплантации. Современные методы консервации позволяют в большинстве случаев поддерживать жизнеспособность донорских органов в течение 24— 36 ч. Сердце и легкие удается сохранить только в течение 6 ч в специально приготовленных растворах.
Существует два метода сохранения жизнеспособности взятых донорских органов. После промывания органа охлажденным до +4 °С раствором ЕвроКоллинз орган сохраняют в том же растворе на холоду при указанной выше температуре. Некоторые центры трансплантации после изъятия почки и отмывания ее от крови раствором Коллинза подключают орган к перфузионному аппарату для длительной перфузии при температуре +5—8 °С.
При взятии органов необходимо бережно, щадяще выполнять каждый этап операции, чтобы не повредить поверхность органа и избежать кровотечения; сосуды выделять с частью сосудов, от которых берут начало сосуды изымаемого органа. При взятии почки необходимо предотвратить деваскуляризацию мочеточника, а при взятии печени — общего желчного протока. Это облегчит последующую трансплантацию и позволит избежать некоторых осложнений.
Источники донорских органов
Донорами органов и тканей для трансплантации могут быть: 1) живые доноры — ближайшие родственники (однояйцовые близнецы, братья, сестры, родители); 2) живые доноры, не имеющие родственных связей с реципиентом (родственники мужа или жены, друзья, близкие знакомые);
3) мертвые доноры — трупы внезапно умерших от остановки сердца людей (биологическая смерть) и людей со смертью мозга, но с продолжающимся сокращением сердца.
Мертвые доноры с постоянно бьющимся сердцем и перфузией органов определяются по неврологическим критериям смерти мозга. Биологическую смерть определяют по сердечным критериям (полная остановка сокращений сердца).
Для обозначения особенностей трансплантации используют специальную терминологию:
—
аутогенная трансплантация — донор и реципиент одно и то же лицо;
—
изогенная трансплантация — донор и реципиент однояйцовые близнецы;
—
сингенная трансплантация — донор и реципиент родственники первой степени;
—
аллогенная трансплантация — донор и реципиент принадлежат к одному виду (например, пересадка от человека человеку);
—
ксеногенная трансплантация — донор и реципиент принадлежат к разным видам (например, пересадка от обезьяны человеку).
Для обозначения пересадки органа на его обычное место принят термин ортотопическая трансплантация. При пересадке органа на любое другое анатомическое место говорят о гетеротопической трансплантации.
Если отсеченный орган или оторванная часть тела вновь вживляются в организм хозяина, то такую операцию называют реплантацией. Аллопластическая трансплантация — замена органа или ткани синтетическими материалами.
Живой донор должен быть совершеннолетним, в полном сознании, способным принимать решение добровольно, без постороннего давления. Донор должен быть физически и психически совершенно здоровым, способным перенести операцию по изъятию органа без значительного риска для здоровья. В ряде стран пересадка почки или 2—3 сегментов печени от живых доноров производятся довольно часто (40—60 % от общего числа трансплантаций указанных органов).
В случае дальнейшего улучшения иммунодепрессивной терапии и увеличения приживляемости пересаженных органов только недостаток трупных органов может оправдать использование органов от живых доноров. В нашей стране взятие органа от живого донора, не являющегося близким родственником, из этических и юридических соображений запрещено.
Мертвый донор. Различают доноров, погибших от остановки сокращений сердца (биологическая смерть), и доноров с мозговой смертью, но с бьющимся сердцем.
У доноров с биологической смертью необходимо как можно быстрее после остановки сердца произвести холодовую консервацию органов, чтобы сократить время тепловой ишемии, вызывающей дистрофические изменения в органах и резко снижающей возможность восстановления нормальной функции после пересадки органа.
В настоящее время в ряде стран большинство органов для пересадки берут от доноров с мозговой смертью или от живых доноров. В США ежегодно около 20 000 доноров с мозговой смертью используют для взятия и пересадки органов. Доноры с мозговой смертью — это обычно пациенты с тяжелой черепно-мозговой травмой или кровоизлиянием в мозг, у которых функция мозга необратимо утрачена, в то время как другие функции организма поддерживаются благодаря интенсивной терапии. Смерть мозга, по общему согласию ученых большинства стран, приравнивается к смерти индивидуума.
Иммунологическая теория отторжения трансплантата
зародилась в первом десятилетии XX века и поддерживалась многими учеными, однако прямых доказательств этого предположения не было, так как не удавалось выявить антитела против трансплантированного органа, которые разрушали бы пересаженный орган. В 1914 г. Murphy заметил скопление лимфоцитарных инфильтратов вокруг пересаженной ткани донора и предположил, что именно мелкие лимфоциты являются причиной ее отторжения. В то время разница между клеточным иммунитетом, осуществляемым лимфоцитами, не была четко отличима от гуморального иммунитета, связанного с образованием антител. В 1954 г. Billingham, Brent, P. Medawar показали, что лимфоидные клетки являются переносчиками иммунитета на пересаженные ткани. Только живые клетки способны передавать иммунитет. Этот феномен получил название приобретенного адоптивного иммунитета, чтобы отличить его от пассивного иммунитета, вызываемого введением антител.
В 1958 г. J. Dausset удалось обнаружить лейкоцитарные антигены тканевой несовместимости — систему HLA-антигенов. Эти открытия позволили понять природу гистосовместимости и причину отторжения трансплантирс ванного органа. Таким образом, в 60-х годах была решена сложная задач разработки методики типирования тканей и определения гистосовместимс сти донора и реципиента по лейкоцитарным антигенам HLA (производнс от английских слов Human Leukocyte Antigen) системы и ABO антигена; (группам крови).
Но даже при пересадках органов и тканей с учетом HLA-антигено трансплантаты часто отторгались иммунной системой реципиента. Необхс димо было изыскать методы подавления иммунной системы реципиенте чтобы добиться приживления пересаженного органа. В 1959 г. R. Schwartz
W. Dameschek открыли иммунодепрессивное действие 6-меркаптурина. Эт открытие положило начало фармакологической иммунодепрессии, изыска нию новых иммунодепрессантов (кортикостероиды, азатиоприн) и позволи ло широко применять пересадку аллогенных органов.
Важное место в развитии трансплантологии занимает техническое обес печение. Помимо разработки методики наложения сосудистого шва, необ ходимо было разработать оптимальное сохранение донорского органа от те пловой ишемии, методику взятия органа вместе с сосудами, методику кон сервации и транспортировки органа в хирургическое отделение. Создание специальных центров для трансплантации позволило составить лист реци пиентов, ожидающих трансплантацию, с подробной характеристикой гисто совместимости, организовать донорство аллогенных органов, сконцентри ровать технические средства, необходимые для определения гистосовмести мости тканей донора и реципиента, в специальных центрах, установит) средства связи и доставки донорских органов.
Для иммунодепрессии были использованы различные подходы, ВКЛКУ чающие подавление активности всей иммунной системы тотальным облучением [Hamburger J., 1962] или фармакологическими средствами — иммунодепрессантами. Число препаратов для иммуносупрессии и их эффективность постепенно увеличиваются. Вместо иммунодепрессантов, которые угнетают целиком активность иммунокомпетентных клеток и ослабляют защитные свойства организма от инфекции и возможного появления злокачественных опухолей, появляются препараты, которые избирательно действуют на отдельные звенья иммунологической реакции отторжения, не угнетая функцию иммунокомпетентных клеток целиком. Усовершенствованная методика иммунодепрессантной терапии позволила более уверенно подавлять реакцию отторжения. Это, несомненно, способствовало более широкому использованию трансплантации органов и тканей.
К началу 80-х годов были разработаны теоретические и оперативнотехнические, юридические и организационные аспекты трансплантологии. Трансплантология получила прочную основу, для того чтобы пересадка органов вышла из стадии клинических испытаний в некоторых клиниках и центрах и стала доступной для многих специализированных учреждений.
Весомый вклад в развитие трансплантологии внесли отечественные ученые. В 1928 г. Н. П. Брюхоненко — профессор медицинского факультета Московского университета — создал первый аппарат для проведения искусственного кровообращения во время оперативных вмешательств. Эта идея была использована для создания современных аппаратов искусственного кровообращения, без которых невозможны оперативные вмешательства на "открытом" сердце, трансплантации сердца, комплекса сердце — легкие, печени. В 1933 г. харьковский хирург Ю. Вороной впервые в мире произвел пересадку почки больному с острой почечной недостаточностью, возникшей вследствие отравления сулемой. Операция под местной анестезией длилась 6 ч. Он произвел еще 6 пересадок в период с 1933 по 1949 г. Функция пересаженной почки не восстановилась ни разу. Первая успешная трансплантация почки с длительным сроком жизни реципиента была произведена в 1954 г. Murray и Merrill в Бостоне от идентичных однояйцовых близнецов. Пациент с пересаженной почкой жил в течение многих лет.
В. П. Демихов в 1960 г. подвел итоги своих многочисленных экспериментов по пересадке сердца, головы собаки на шею собаки-реципиента. Он впервые в мире произвел пересадку комплекса сердце — легкие в эксперименте. Опубликованная им монография "Пересадка жизненно важных органов" была переведена на английский, немецкий и испанский языки. Автор первой успешной пересадки сердца человеку [Barnard С, 1967] специально приезжал в лабораторию В. П. Демихова, чтобы познакомиться с деталями техники трансплантации.
Первая успешная пересадка почки в России от близкого родственника была произведена Б. В. Петровским в 1965 г., а первая успешная пересадка сердца — В. И Шумаковым.
Наиболее значимые успехи были достигнуты за последние 10—15 лет. К концу 90-х годов в мире было организовано более 230 центров по трансплантации органов (в том числе 7 в России), законодательно регламентированы условия изъятия органов у доноров, взаимоотношения между донором, реципиентом, родственниками и медицинским персоналом. В 1992 г. принят закон Российской Федерации о трансплантации органов и(или) тканей человека, что создало благоприятные предпосылки для пересадки органов у практически безнадежных больных.
До 1990 г. во всем мире было произведено 13 000 пересадок органов. В 1992 г. только за один год было выполнено 16 605, в 1996 г. уже 20 014, в 2000 г. — около 50 000 трансплантаций в США и Европе и более 10 000 в других частях света. Более половины из них — трансплантация почек, одна треть — пересадка печени и сердца. Оставшаяся часть приходится на другие органы — поджелудочную железу, легкие, тонкую кишку, комбинированные пересадки. Быстро увеличивается число пересадок печени, поджелудочной железы, сердца.
Недостаток донорских органов и трудности, связанные с финансированием, лимитируют проведение этих дорогостоящих оперативных вмешательств. Больных, ожидающих трансплантацию, в 3 раза больше числа пациентов, получивших орган от донора. Для трансплантации тканей не нужен донор с бьющимся сердцем, поэтому пересадка клапанов сердца, роговицы, кожи, костей и продуктов соединительной ткани не ограничена.
Трансплантация органов и тканей
Трансплантация органов и тканей поистине является величайшим достижением XX столетия. О замене утраченной или больной части тела органом, взятым у другого человека, люди мечтали столько тысячелетий, сколько существует человек разумный. Памятники истории свидетельствуют о том, что задолго до нашей эры, в средние века делались попытки пересадки утраченных частей тела, Однако эти попытки, как правило, были безуспешны в связи с отсутствием научной базы. Пересаженная ткань отторгалась, а переливание крови от одного человека другому заканчивалось смертью реципиента.
Трансплантация органов началась в XX столетии с разработки техники сосудистого шва и первых экспериментальных пересадок почки [Ullmann E., 1902]. и сердца [Carrel А., 1905]. За период с 1902 по 1912 г. A. Carrel,
D. Guthrie с сотрудниками произвели серию трансплантаций органов на животных, включая пересадку почки, сердца, селезенки, яичников, конечностей и даже головы. A. Carrel недоумевал, почему орган, взятый от другого животного, отторгается, а орган, взятый от животного и реплантированный ему же, приживает и нормально функционирует несмотря на применение одинаковой хирургической техники. Он предположил, что этот феномен объясняется биологическими свойствами реципиента. Изучение предполагаемого A. Carrel биологического феномена отторжения пересаженного органа заняло несколько десятилетий и продолжается до настоящего времени.
Гормонально-неактивные опухоли Лечение.
Выявление гормональной активности опухоли является показанием к операции. Подлежат хирургическому удалению и образования, превышающие 3 см в диаметре при отсутствии гормональной активности. Опухоли меньшего размера, но имеющие признаки злокачественного роста (быстрый рост, неоднородность ткани, неровность и нечеткость контуров, наличие микрокальцинатов, обильная васкуляризация, атипичные клетки при ТАБ и др.), также подлежат оперативному лечению в специализированном стационаре. Динамическое наблюдение за больным со случайно выявленными опухолями надпочечников оправдано при небольших размерах образований (менее 3 см), отсутствии признаков злокачественного роста и гормональной активности.
Таким образом, термины "инциденталома" или "адреналома" являются собирательными понятиями и указывают на то, что выявленная (чаще случайно) опухоль не привела к развитию типичной клинической картины эндогенного гиперкортицизма, первичного гиперальдостеронизма, феохромоцитомы, феминизирующей или вирилизирующей опухоли. Этот диагноз должен рассматриваться лишь как предварительный (рабочий) и нацеливать врача на применение определенного алгоритма исследований с целью установления клинического диагноза и принятия оптимального решения о тактике ведения больного (операция, наблюдение).
Гормонально-неактивные опухоли
Опухоли надпочечников, не приводящие к развитию характерных клинических признаков гиперкортицизма, первичного гиперальдостеронизма, феохромоцитомы, феминизирующей или вирилизирующей опухоли, долгое время считались сравнительно редкими образованиями. Они являются, как правило, случайной находкой при выполнении УЗИ, КТ или МРТ органов брюшной полости и забрюшинного пространства, предпринятых по поводу других заболеваний. Применяемый в таких случаях термин "инциденталома" или "адреналома" подчеркивает, что опухоль выявлена случайно и клинически асимптоматична. Частота обнаруженных таким образом опухолей надпочечников неуклонно возрастает и колеблется в пределах 1,5—10 %. Обычно они встречаются в возрасте 30—60 лет, чаще у женщин и в 60 % имеют левостороннюю локализацию. В 3—4 % наблюдений опухоль выявляют в обоих надпочечниках. Среди всех больных, находящихся на обследовании по поводу различных заболеваний надпочечников, частота инциденталом достигает 18—20 %. По данным секционных статистик, случайно выявленные опухоли надпочечников встречаются в 1,5—8,7 % наблюдений.
При выявлении инциденталомы дальнейшую дифференциальную диагностику проводят среди следующих основных групп заболеваний:
—
первичное поражение самих надпочечников (опухоли, гиперпластические изменения, кисты, гематомы и др.);
—
вторичное, метастатическое поражение надпочечников (метастазы рака легких, молочной железы, щитовидной железы, толстой кишки, почки, меланомы и др.) — 8—13 %;
—
псевдонадпочечниковые поражения, имитирующие опухоль надпочечников (заболевания почек, тела и хвоста поджелудочной железы, селезенки, расположенных рядом крупных сосудов и др.).
Важно помнить о возможности патологических изменений в эктопированной надпочечниковой ткани.
Среди заболеваний надпочечников наиболее часто выявляют аденомы коркового вещества (около 30 %), аденоматоз или диффузно-узелковую гиперплазию коры надпочечника, феохромоцитому (10 %), намного реже встречаются кисты (ретенционные, паразитарные) и псевдокисты надпочечников (менее 0,08 %), липомы, миелолипомы (менее 0,2 %), лимфомы, сосудистые опухоли надпочечников и др. Ежегодная частота рака коры надпочечников обычно не превышает 2 наблюдений на 1 млн населения (0,02—0,04 % всех злокачественных опухолей).
В топической диагностике наибольшее значение придают полипозиционному УЗИ (при необходимости в сочетании с тонкоигольной аспирационной биопсией — ТАБ), КТ, МРТ, селективной ангиографии (артериографии, флебографии). Реже используют радионуклидную сцинтиграфию (ПЧ либо 1231-метайодбензилгуанидин, избирательно накапливающийся в хромаффинной ткани, радиофармпрепарат NP-59 или 13|1-19-йодхолестерол, накапливаемый гиперфункционирующей корковой тканью).
Комплексное применение методов топической диагностики (УЗИ, КТ, МРТ) позволяет выявить опухолевые изменения надпочечников размером 5 мм.
Для дифференциальной диагностики злокачественных кортикостером используют иммуногистохимические реакции: положительную реакцию с Р-53 и отсутствие моноклональных антител к кератинам. Одним из онкомаркеров считают дегидроэпиандростерона сульфат (ДГЭАС), уровень которого при раке коры надпочечников обычно повышен. Следует отметить, что в ряде случаев случайно выявленные гормонально-неактивные опухоли надпочечников на самом деле проявляют некоторую гормональную активность, которая, однако, не приводит к появлению заметных клинических симптомов (так называемый преклинический синдром Кушинга, альдостеромы, феохромоцитомы и др.). Для оценки функциональной активности выявленной опухоли определяют содержание свободного кортизола, катехоламинов, альдостерона, ванилилминдальной кислоты и гомованилиновой кислоты в суточной моче, применяют малую дексаметазоновую пробу. Даже при отсутствии клинических признаков эндогенного гиперкортицизма и нормальном уровне кортизола в суточной моче и крови, но отсутствии суточного ритма его секреции и подавлении секреции дексаметазоном следует предположить преклинический синдром Кушинга. В сложных диагностических случаях функциональную активность опухоли оценивают по результатам селективной надпочечниковой флебографии с определением уровня гормонов в оттекающей венозной крови (важно помнить о возможности развития криза при наличии феохромоцитомы и исключить ее до исследования).
Лечение катехоламинпродуцирующих опухолей
только хирургическое и должно проводиться в специализированных стационарах. Большая вероятность развития в ходе операции смертельно опасных гемодинамических нарушений и метаболических расстройств требует тщательной медикаментозной подготовки больного в предоперационном периоде, прецизионной хирургической техники оперирования и высококвалифицированного анестезиологического обеспечения. В комплексной предоперационной подготовке используют ос-адреноблокаторы (феноксибензамин, празозин, реджитин), ингибиторы синтеза катехоламинов (а-метилпаратирозин), блокаторы кальциевых каналов (нифедипин, верапамил и др.), при выраженной тахикардии, нарушениях ритма — (3-адреноблокаторы (обзидан, атенолол и др., но только на фоне приема а-адреноблокаторов и эффективного контроля артериального давления), седативные и снотворные препараты.
При развитии катехоламинового криза вводят внутривенно фентоламин, реджитин, натрия нитропруссид, нитроглицерин. Если гипертонический криз становится затяжным и его не удается купировать консервативной терапией в течение 2,5—3 ч, развивается катехоламиновый шок (неуправляемая гемодинамика) и тогда предпринимают экстренную операцию по жизненным показаниям.
Прогноз в целом благоприятный, в том числе и при феохромобластоме, если не выявляются отдаленные метастазы. Рецидив заболевания возможен примерно в 5—12 % наблюдений. Примерно в 50 % случаев сохраняется тенденция к тахикардии, умеренная транзиторная или постоянная артериальная гипертензия, хорошо контролируемая медикаментозными средствами.
Феохромоцитома Клиническая картина, диагностика.
Феохромоцитома отличается от других гормонально-активных опухолей надпочечников наиболее значимыми и опасными нарушениями гемодинамики. По клиническому течению выделяют пароксизмальную, постоянную и смешанную форму заболевания. Пароксизмальная форма является наиболее частой (35—85 %) и характеризуется внезапным резким повышением артериального давления (до 250—300 мм рт. ст. и выше), сопровождающимся головной болью, головокружением, сердцебиением, чувством страха, бледностью кожных покровов, потливостью, дрожью во всем теле, болями за грудиной и в животе, одышкой, нарушением зрения, тошнотой, рвотой, полиурией, повышением температуры тела.
Такие характерные для пароксизмальной формы феохромоцитомы симптомы, как головная боль, сердцебиение и повышенное потоотделение, объединяют в триаду Карнея, которая встречается у 95 % больных. Важными диагностическими признаками катехоламинового криза считают также микроцитоз, эритроцитоз, лимфоцитоз, гипергликемию и глюкозурию. Обычно приступ провоцируют физическое напряжение, изменение положения тела, пальпация опухоли, обильный прием пищи или алкоголя, стрессовые ситуации (травмы, операции, роды и др.), мочеиспускание. Продолжительность феохромоцитомных кризов весьма вариабельна — от нескольких минут до нескольких часов.
Постоянна я форм а заболевания проявляется стойким повышением артериального давления и схожа с течением эссенциальной гипертонической болезни. Для смешанно й форм ы характерно возникновение феохромоцитомных кризов на фоне постоянно повышенного артериального давления.
При тяжелом течении феохромоцитомного криза, не поддающегося влиянию консервативной терапии, возможна беспорядочная смена высокого и низкого артериального давления — неуправляемая гемодинамика. Это угрожающее жизни больного состояние называют катехоламиновым шоком , который развивается у 10 % больных, чаще у детей.
Большие дифференциальнодиагностические трудности могут быть обусловлены вариабельностью симптоматики при феохромоцитоме, возможностью нетипичного течения заболевания и наличием клини ческих "масок". Наиболее часто описывают такие клинические "маски", как тиреотоксический криз, инфаркт миокарда, инсульт, заболевания почек, абдоминальный синдром с картиной "острого живота", токсикоз беременных, диэнцефальный (гипоталамический) синдром и др.
Лабораторные методы диагностики направлены на выявление высокого уровня катехоламинов и их метаболитов в моче. Прежде всего исследуют экскрецию катехоламинов, ванилилминдальной и гомованилиновой кислоты с суточной мочой (точность метода достигает 95 %) либо в моче, собранной в течение 3 ч после гипертонического криза. Определение уровня катехоламинов в крови имеет меньшее диагностическое значение и оправдано во время приступа.
В топической диагностике наибольшее значение имеют УЗИ, КТ и МРТ (рис. 27.3). В последние годы используют радионуклидную сцинтиграфию с метайодбензилгуанидином, меченным ш1 или 1231, избирательно накапливаемом в опухоли и ее метастазах. В сложных диагностических ситуациях, особенно при вненадпочечниковой локализации феохромоцитомы, применяют ангиологические технологии — артериографию (рис. 27.4), флебографию. Флебографию сочетают с селективным забором венозной крови из "зон интереса" в системе нижней и верхней полой вен для определения уровня катехоламинов. В зоне расположения опухоли концентрация катехоламинов в оттекающей венозной крови значительно выше.
Феохромоцитома
Феохромоцитома (хромаффинома) — опухоль, происходящая из хромаффинных клеток диффузной нейроэндокринной системы (APUD-системы). Наиболее компактная их локализация отмечена в мозговом слое надпочечников. В то же время хромаффинную ткань можно обнаружить в области симпатических ганглиев и сплетений, по ходу брюшной аорты (особенно у места отхождения нижней брыжеечной артерии — орган Цуккеркандля), области солнечного сплетения, в воротах печени и почек, в стенке мочевого пузыря, в широкой связке матки, по ходу кишечника, в средостении, миокарде, на шее, в полости черепа и др.
Заболевание несколько чаще встречается у женщин, обычно в возрасте 30—50 лет. 10 % больных составляют дети. Частота в популяции —
1 : 200 000, хотя некоторые авторы считают ее более высокой.
В 90 % наблюдений опухоль исходит из мозгового слоя надпочечников, однако в 10 % выявляют поражение обоих надпочечников. В 10 % случаев отмечается вненадпочечниковая локализация опухоли (параганглиомы), 10 % хромаффинных опухолей имеют семейный характер и примерно в 10 % наблюдений встречаются злокачественные феохромоцитомы (так называемое правило 10 %). Злокачественные феохромоцитомы называют феохромобластомами, они чаще имеют вненадпочечниковую локализацию.
Семейный характер заболевания обычно связывают с развитием синдрома множественной эндокринной неоплазии II типа (МЭН ПА и МЭН ПБ), описаны сочетания феохромоцитомы с болезнью Реклингхаузена, болезнью фон Хиппеля—Линдау (ангиоматоз сетчатки и гемангиобластома мозжечка) и другими заболеваниями.
Патогенез. Основное значение придают повышенной продукции опухолью катехоламинов. Патологические изменения касаются практически всех органов и систем организма, особенно сердечно-сосудистой, нервной и эндокринной. Адреналин оказывает стимулирующее действие преимущественно на сс2- и р2-адренергические рецепторы, норадреналин — на а,-и Р,-адренорецепторы. Влияние адреналина обусловливает увеличение частоты сердечных сокращений, сердечного выброса, повышение систолического артериального давления и возбудимость миокарда (возможны нарушения ритма сердечных сокращений), спазм сосудов кожи, слизистых оболочек и органов брюшной полости. Адреналин вызывает гипергликемию и усиливает липолиз. Норадреналин повышает как систолическое, так и диастолическое артериальное давление, вызывает спазм сосудов скелетных мышц, увеличивая периферическое сопротивление. Влиянием норадреналина — основного медиатора симпатической нервной системы — обусловлены вегетативно-эмоциональные нарушения — возбуждение, испуг, тахикардия, расширение зрачка, обильное потоотделение, полиурия, пилоэрекция и др. Значительные изменения вегетативного и психоэмоционального характера вызывает дофамин.
Длительная гиперкатехоламинемия и артериальная гипертензия приводят к изменениям миокарда (так называмая катехоламиновая миокардиодистрофия) вплоть до развития некоронарогенных некрозов миокарда. Избыточное поступление катехоламинов в кровь вызывает спазм периферических сосудов с централизацией кровообращения, гиповолемической артериальной гипертензией, ишемическую атрофию канальцевого эпителия почек.
Полагают, что в патогенезе заболевания имеет значение не только поступление большого количества катехоламинов в кровоток, но и возникающее истощение депрессорной системы, а также повышение чувствительности самих адренергических рецепторов.
Кортикоэстрома
Кортикоэстрома — опухоль коры надпочечников, в избытке продуцирующая эстрогены. Встречается очень редко, обычно злокачественная. Гиперпродукция эстрогенов ведет к развитию симптомов феминизации (феминизирующая опухоль).
Клиническая картина, диагностика. У девочек заболевание проявляется ускоренным физическим и ранним половым развитием, у мальчиков — отставанием полового созревания. У мужчин выявляют симптомы феминизации — гинекомастию, распределение жировой клетчатки по женскому типу, отсутствие волос на лице, повышение тембра голоса, атрофию яичек и полового члена, нарушение половой функции, олигоспермию.
В диагностике важное значение имеет повышение уровня эстрогенов (эстрадиола) в крови, результаты УЗИ, КТ или МРТ. Для выявления отдаленных метастазов исследуют легкие, печень, кости.
Лечение — хирургическое, удаление опухоли с пораженным надпочечником. Химиотерапию проводят хлодитаном, митотаном, лизодреном. Прогноз аналогичен таковому при андростероме.
Андростерома
Опухоль развивается из сетчатой зоны коркового вещества либо из эктопической ткани надпочечников (забрюшинная жировая клетчатка, яичники, семенные канатики, широкая связка матки и др.). Ее частота не превышает 3 % среди других опухолей надпочечников, до 50 % андростером злокачественные. Андростерома встречается у женщин в 2 раза чаще, чем у мужчин, обычно в возрасте 20—40 лет.
Клиническая картина, диагностика. Избыточная продукция опухолевыми клетками андрогенов (дегидроэпиандростерона, андростендиона, тестостерона и др.) обусловливает развитие вирильного и анаболического синдромов. Возможна повышенная продукция опухолью и других гормонов, например глюкокортикоидов, что влечет появление в клинической картине симптомов гиперкортицизма.
При возникновении заболевания в детском возрасте отмечают раннее половое и физическое развитие — ускорение роста, чрезмерное развитие мускулатуры, огрубение голоса. У девочек развивается гипертрофия клитора, отсутствует рост молочных желез и менструации, отмечается гипертрихоз, появляется угревая сыпь на лице и туловище, у мальчиков — ускоренное развитие вторичных половых признаков при атрофии яичек. В последующем рост детей замедляется. При возникновении опухоли у женщин отмечают явления маскулинизации, при этом грубеет голос, прекращаются менструации, происходит атрофия молочных желез, матки, гипертрофия и вирилизация клитора, усиливается рост волос на лице, теле и конечностях (гирсутизм). У мужчин клинические проявления вирилизации менее выражены, поэтому андростерома может стать случайной находкой.
Диагноз подтверждают результаты лабораторных исследований — отмечают повышенное содержание в крови дегидроэпиандростерона, андростендиона и тестостерона. При этом прием дексаметазона не подавляет повышенную продукцию андрогенов, что свидетельствует об автономном функционировании опухоли.
В топической диагностике опухоли наибольшее значение имеют УЗИ, КТ, МРТ. Для выявления отдаленных метастазов применяют рентгенографию грудной клетки, УЗИ и КТ брюшной полости, сцинтиграфию костей.
Лечение хирургическое — удаление опухоли вместе с пораженным надпочечником. Прогноз при своевременном удалении доброкачественной опухоли благо
приятный, однако пациенты нередко остаются низкорослыми. В случае злокачественной андростеромы, особенно при наличии отдаленных метастазов (печень, легкие), прогноз неблагоприятный. Химиотерапию злокачественных опухолей проводят хлодитаном, митотаном, лизодреном.
Кортикостерома Клиническая картина и диагностика.
Клиническая картина весьма характерна и проявляется развивающимся симптомокомплексом гиперкортицизма. Изменения выявляют практически во всех органах и системах. Наиболее ранними и постоянными проявлениями заболевания считают центрипетальный тип ожирения (кушингоидное ожирение), артериальную гипертензию (90—100 %), головную боль, повышенную мышечную слабость и быструю утомляемость, нарушение углеводного обмена (нарушение толерантности к глюкозе, или стероидный диабет, — 40—90 %) и половой функции (дисменорея, аменорея). Обращают внимание на синюшно-багровые полосы растяжения (стрии) на коже живота, молочных желез и внутренних поверхностей бедер, петехиальные кровоизлияния. У женщин отмечают явления вирилизма — гирсутизм, барифонию, гипертрофию клитора, у мужчин — признаки демаскулинизации — снижение потенции, гипоплазию яичек, гинекомастию. Развивающийся у большинства пациентов остеопороз может являться причиной компрессионных переломов тел позвонков. У 25—30 % пациентов выявляют мочекаменную болезнь, хронический пиелонефрит. Нередко развиваются психические нарушения (возбуждение, депрессия).
Довольно яркие клинические проявления гиперкортицизма, сочетающиеся с повышением суточной экскреции свободного кортизола с мочой, свидетельствуют о наличии синдрома Иценко—Кушинга. Для дифференциальной диагностики кортикостеромы, болезни Ицен
ко—Кушинга и эктопированного АКТГ-синдрома используют большую дексаметазоновую пробу (большая проба Лиддла), определяют уровень АКТГ. При наличии кортикостеромы прием дексаметазона (8 мг внутрь в 24 ч) не приводит к снижению уровня кортизола крови (забор проводят на следующий день в 8 ч утра). Повышенный уровень АКТГ свидетельствует о вероятном АКТГ-эктопическом синдроме. Топическая диагностика кортикостеромы основывается на применении полипозиционного УЗИ, КТ и МРТ (рис. 27.2), чувствительность которых достигает 90—98 %. Возможно использование сцинтиграфии надпочечников с 13|1-19-холестеролом.
Лечение. Единственным радикальным методом лечения кортикостеромы является хирургический. В последние годы для этих целей все чаще используют минимально инвазивные эндовидеохирургические операции. При злокачественной опухоли после операции назначают хлодитан.
Высокая вероятность развития в раннем послеоперационном периоде острой надпочечниковой недостаточности, обусловленной атрофией контралатерального надпочечника, требует применения своевременной (профилактической) и адекватной заместительной терапии.
Прогноз при доброкачественных кортикостеромах благоприятный; в случаях злокачественных опухолей, как правило, неблагоприятный.
Альдостерома Лечение.
При альдостеронпродуцирующей опухоли надпочечника показана адреналэктомия (удаление опухоли вместе с пораженным надпочечником). Однозначного мнения о выборе метода лечения при двусторонней гиперплазии надпочечников нет; как правило, применяют консервативную терапию (верошпирон, препараты калия, антигипертензивные средства).
При выраженной диффузно-узловой гиперплазии, значительном повышении функциональной активности одного из надпочечников, неэффективности консервативной терапии возможно выполнение односторонней адреналэктомии.
После удаления альдостеромы примерно у 70 % больных артериальное давление нормализуется, еще у 20—25 % сохраняющаяся умеренная гипертензия легко корригируется консервативной терапией. Значительно хуже результаты хирургического лечения при диффузно-узловой гиперплазии коры надпочечников.
Кортикостерома
Кортикостерома — гормонально-активная опухоль, развивающаяся из пучковой зоны коры надпочечников. Избыточная продукция кортизола опухолью приводит к развитию эндогенного гиперкортицизма — синдрома Иценко—Кушинга [Иценко Н. М., 1924; Cushing H., 1932]. Различают следующие формы тотального эндогенного гиперкортицизма:
1) болезнь Иценко—Кушинга — АКТГ-зависимая форма заболевания, обусловленная опухолью гипофиза (кортикотропиномой) либо гиперплазией кортикотрофов аденогипофиза;
2) синдром Иценко—Кушинга, вызываемый опухолью коры надпочечника, автономно секретирующей избыточное количество гормонов;
3) АКТГ-эктопированный синдром, обусловленный опухолями диффузной нейроэндокринной системы, секретирующими кортиколиберин (КРГ), АКТГ или им подобные соединения (опухоли легких, вилочковой железы,
поджелудочной железы, щитовидной железы, яичка, яичников, предстательной железы, пищевода, кишечника, желчного пузыря и др.);
4) автономная макронодулярная гиперплазия коры надпочечников.
Выделяют доброкачественные кортикостеромы (аденомы), составляющие более 50 % наблюдений, и злокачественные кортикостеромы (кортикобластомы, аденокарциномы). Чем меньше размер опухоли и больше возраст больного, тем более вероятен ее доброкачественный характер. Кортикостерома является наиболее частой опухолью коркового вещества надпочечников.
Патогенез заболевания обусловлен избыточной длительной продукцией опухолью глюкокортикоидов, в меньшей степени — минералокортикоидов и андрогенов и особенностями биологических эффектов гормонов на тканевом уровне.
Альдостерома Клиническая картина, диагностика.
Клинические проявления болезни могут быть объединены тремя основными синдромами — сердечно-сосудистым, нервно-мышечным и почечным.
Сердечно-сосудистый синдром характеризуется, как правило, стойкой артериальной гипертензией, головными болями, изменениями глазного дна, гипертрофией миокарда левого желудочка, дистрофией миокарда. Возникновение названных изменений связывают с задержкой натрия в тканях организма, гиперволемией, отеком интимы, уменьшением просвета сосудов и увеличением периферического сопротивления, повышением чувствительности сосудистых рецепторов к воздействию прессорных факторов.
Нервно-мышечный синдром проявляется мышечной слабостью различной выраженности, реже — парестезиями и судорогами, что обусловлено гипокалиемиеи, внутриклеточным ацидозом и развивающимися на этом фоне дистрофическими изменениями мышечной ткани и нервных волокон.
Почечны й синдром , обусловленный так называемой калиепенической нефропатией, характеризуется жаждой, полиурией, никтурией, изогипостенурией, щелочной реакцией мочи.
Бессимптомные формы встречаются в 6—10 % наблюдений. В диагностике заболевания придают значение повышенному артериаль
ному давлению в сочетании с гипокалиемиеи, гиперкалиурией, повышением базального уровня альдостерона в крови и суточной экскреции с мочой, снижением активности ренина плазмы. Принимают во внимание наличие гипернатриемии, гипохлоремического внеклеточного алкалоза, увеличение объема циркулирующей крови. В сложных диагностических случаях применяют тес т с подавлени
ем секреции альдостерона 9а-фторкортизолом (кортинефом). В течение 3 сут больному назначают по 400 мкг препарата в день. При
автономной альдостеронпродуцирующей аденоме (альдостероме) снижения уровня альдостерона не происходит, а при идиопатическом ПГА отмечается снижение уровня альдостерона в крови. Используют также маршевую пробу (при альдостероме сниженный уровень ренина не повышается, повышенный уровень альдостерона снижается или не меняется).
В целях уточнения характера поражения надпочечников (альдостерома, гиперплазия) используют УЗИ, КТ или МРТ (рис. 27.1), чувствительность которых, т. е. способность выявить изменения при их наличии, достигает 70—98 %.
Функциональную активность надпочечников можно оценить при селек тивной флебографии путем определения уровня альдостерона и кортизола в крови, оттекающей от правого
и левого надпочечника. Пятикратное увеличение соотношения альдостерон/кортизол можно рассматривать как подтверждение наличия альдостеромы.
Альдостерома
Альдостеромой называют опухоль, исходящую из клеток клубочковой зоны коры надпочечников, приводящую к развитию синдрома первичного гиперальдостеронизма — синдрома Конна [Conn J. W., 1955]. Доброкачественные опухоли надпочечников (аденомы) являются основной причиной первичного гиперальдостеронизма (ПГА), составляя 70—85 % наблюдений. Менее чем в 5 % случаев опухоли имеют злокачественный характер (злокачественные альдостеромы). Среди других причин развития ПГА описывают двустороннюю или одностороннюю гиперплазию коркового вещества надпочечников (диффузную, диффузно-узловую) — 25—30 %, глюкокортикоидподавляемый ПГА, альдостеронпродуцирующие опухоли вненадпочечниковой локализации (щитовидной железы, яичников и др.), встречающиеся весьма редко.
Заболевание чаще проявляется в возрасте 30—50 лет, соотношение мужчин и женщин составляет 1:3. Важно отметить, что среди всех больных, страдающих артериальной гипертензией, порядка 1,5—2 % наблюдений обусловлено ПГА.
В основе патогенеза заболевания лежат изменения в различных органах и системах, обусловленные повышенной продукцией альдостерона (см. раздел "Функциональная морфология надпочечников").
Секреция кортизола
равно как и АКТГ, в норме подчиняется определенному суточному ритму — максимальный уровень гормона в крови отмечается в утренние часы (6—8 ч), минимальный — в ночное время.
Мозгово е веществ о надпочечников содержит два вида больших хромаффинных клеток, секретирующих катехоламины. Одни клетки выделяют адреналин, другие норадреналин. Исходным веществом для синтеза катехоламинов служит тирозин. На долю адреналина приходится около 80 % синтезируемых катехоламинов, при этом вне мозгового вещества надпочечников он не образуется. Мозговое вещество надпочечников и симпатическая нервная система имеют нейроэктодермальное происхождение. Поэтому надпочечники не являются единственным местом синтеза катехоламинов, а их удаление не приводит к катехоламиновой недостаточности (см. раздел "Феохромоцитома"). Биосинтез катехоламинов происходит в хромаффинных клетках ЦНС, других органов, адренергических симпатических волокнах постганглионарных нейронов. Катехоламины, являясь нейротрансмиттерами, опосредуют функцию ЦНС и симпатической нервной системы, принимают значимое участие в регуляции деятельности сердечно-сосудистой системы.
Выделение катехоламинов из мозгового слоя надпочечников и окончаний ветвей симпатической нервной системы осуществляется под влиянием физиологических стимулов — стресса, психической и физической нагрузки, гиперинсулинемии, гипогликемии, гипотонии и т. п.
Физиологическое влияние катехоламинов на клеточном уровне осуществляется через многочисленные а- и (3-адренергические и дофаминергические рецепторы, расположенные практически во всех органах и тканях (гипоталамус, гипофиз, сердце, сосуды, бронхи, желудок, кишечник, печень, почки, мочевой пузырь, жировая ткань, поперечнополосатая мускулатура, поджелудочная, щитовидная железа и др.). Конечными продуктами обмена катехоламинов являются ванилинминдальная и гомованилиновая кислоты, которые экскретируются с мочой.
В клинической практике хирурги наиболее часто встречаются с различными новообразованиями надпочечников. Опухоли надпочечников могут быть доброкачественными и злокачественными, гормонально-активными с характерными, порой весьма яркими клиническими проявлениями и — чаще — гормонально-неактивными, оказываясь случайной находкой в ходе обследования пациента по поводу другого заболевания.
В корковом веществе надпочечников
происходит биосинтез кортикостероидо в , являющихся производными последовательно холестерина и прегненолона. Выделено порядка ста подобных соединений; вместе с тем лишь немногие из них являются биологически активными. Их можно разделить на три основные группы — глюкокортикоиды, минералокортикоиды и половые гормоны (андрогены и эстрогены). Регуляция синтеза и секреции глюкокортикоидов и половых гормонов находится под контролем суточного ритма адренокортикотропного гормона гипофиза (АКТГ) и осуществляется по принципу отрицательной обратной связи.
Основную роль в механизме регуляции секреции минералокортикоидов отводят ренин-ангиотензиновой системе. Такие факторы, как кровотечение, потеря натрия, обезвоживание, приводят к снижению артериального давления и уменьшению перфузии почек кровью, что. в свою очередь, увеличивает выделение ренина клетками юкстагломерулярного аппарата. Под действием повышенной активности ренина происходит превращение ангиотензина I, синтезируемого в печени, в ангиотензин II, который и оказывает стимулирующее действие на продукцию альдостерона. Полагают, что имеется обратная отрицательная связь, посредством которой ангиотензин II и альдостерон угнетают выделение ренина. Гипонатриемия или гиперкалиемия, вероятно, имеют прямое стимулирующее влияние на кору надпочечников, повышая продукцию альдостерона. Некоторым стимулирующим эффектом на секрецию альдостерона обладает и АКТГ.
Основным местом приложения физиологического действия минералокортикоидов (органы-"мишени") являются почки, а также потовые и слюнные железы, желудок и толстая кишка. Альдостерон обусловливает задержку в организме натрия и воды, выделение калия и водорода, а также оказывает слабое глюкокортикоидное действие.
Глюкокортикоиды повышают концентрацию глюкозы в крови за счет глюконеогенеза в печени и уменьшения ее утилизации на периферии (контринсулярное действие). Они увеличивают распад белка в мышцах и других органах и замедляют его синтез (катаболический эффект). Действие глюкокортикоидов на жировой обмен характеризуется перераспределением подкожной жировой клетчатки, ее отложением в области лица и шеи, увеличением липолиза. Они также обладают противовоспалительным и иммуносупрессивным эффектом. Совместно с катехоламинами и альдостероном глюкокортикоиды поддерживают нормальное артериальное давление. Кортизол обладает также умеренной минералокортикоидной активностью. Имеются данные о стимуляции глюкокортикоидами секреции глюкагона и угнетении секреции инсулина.
Надпочечники
Надпочечник (glandula suprarenalis; epinephros) является парным эндокринным органом, расположенным забрюшинно на уровне Thxl_XM—L„ латеральнее позвоночника, непосредственно у верхнего полюса правой и левой почек. Правый надпочечник обычно меньше левого. Он имеет треугольную или пирамидальную форму, обращен основанием к почке и интимно предлежит к правой доле печени, диафрагме, нижней полой вене, почечной вене. Левый надпочечник имеет лунообразную или серповидную форму, располагается ниже правого и больше по медиальному краю почки. Он граничит с дном желудка, селезенкой, хвостом поджелудочной железы, диафрагмой, селезеночной веной и артерией, аортой и левой почечной веной. Медиальнее обоих надпочечников локализуются полулунные ганглии солнечного сплетения. Надпочечники находятся между листками околопочечной фасции и отделены от почки тонким слоем жировой клетчатки. Покрывающая их тонкая фасция отдает внутрь надпочечниковой железы многочисленные перегородки, несущие сосуды.
Знание топографо-анатомических взаимоотношений надпочечниковых желез с окружающими органами важно для правильной интерпретации результатов методов топической диагностики (УЗИ, КГ, МРТ), выбора оптимальной техники оперирования в сложных условиях, обусловленных глубоким залеганием надпочечников в тесном окружении жизненно важных органов.
Размеры надпочечника взрослого человека составляют в вертикальном направлении 4— 5 см, в поперечном — 2—3 см, в переднезаднем 0,4—0,6 см; масса — 4—6 г — существенно не зависит от пола, возраста и массы тела человека.
Кровоснабжение. Обильное кровоснабжение надпочечников обеспечивается большим числом мелких артерий, берущих начало от нижней диафрагмальной артерии, аорты и почечной артерии.
Перфузия кровью надпочечниковых желез в нормальных условиях осуществляется со скоростью 5—10 мл/мин на 1 г ткани, значительно увеличиваясь при стрессовых состояниях. В противоположность артериальному кровоснабжению надпочечники, как правило, дренируются одной (центральной) веной, отходящей в области ворот железы. Правая центральная вена короче (5—6 мм) и впадает непосредственно в нижнюю полую вену, реже — в правую почечную. С левой стороны надпочечниковая вена длиннее (2—3 см) и впадает в нижнюю диафрагмальную либо непосредственно в левую почечную вену. Центральные вены надпочечников при ранении не спадаются, что может повлечь достаточно обильное кровотечение.
Лимфоотток осуществляется в лимфатические узлы, расположенные непосредственно около надпочечников, в парааортальные и паракавальные лимфатические узлы. Богатая по отношению к их массе симпатическая и парасимпатическая иннервация надпочечников превосходит другие органы. Эктопическая надпочечниковая ткань (может содержать только корковое или мозговое ве
i щество) встречается в жировой клетчатке, рядом с основной железой, а также в области солнечного сплетения, других симпатических сплетениях, в яичке или яичнике, семявыносящем протоке, круглой связке матки, печени, почке, мочевом пузыре. Эктопия мозгового вещества (экстрамедуллярная хромаффинная ткань) более подробно описана в разделе "Феохромоцитома".
В надпочечнике различают корковое вещество (желтого цвета) и мозговое вещество (коричневого цвета). В корковом веществе при микроскопическом исследовании выделяют три зоны — клубочковую (наружную), пучковую и сетчатую. Основные сведения по функциональной морфологии надпочечниковых желез представлены
Фиброз забрюшинной клетчатки
Этиология заболевания неизвестна. Его относят к аутоиммунным идиопатическим заболеваниям. Неспецифический фиброз бывает в средостении (медиастинальный фиброз), в щитовидной железе (зоб Риделя), в желчных путях (склерозирующий холангит). Процессы, протекающие в пораженных органах, одинаковы и, воможно, являются проявлением одной и той же болезни в разных органах.
Ретроперитонеальный фиброз проявляется в основном рубцовым сдавлением мочеточников, нарушением оттока мочи, расширением лоханок почек. При осложнениях инфекцией мочевыводящих путей возможно развитие уросепсиса.
Клинические симптомы болезни зависят от степени сдавления мочеточника, наличия инфекции в мочевыводящих путях и нарушения оттока мочи. Они могут варьировать от легких проявлений в виде болей в поясничной области, гидронефроза, расширения мочеточника выше уровня сдавления его до уремии и уросепсиса. Диагноз устанавливают на основании данных внутривенной урографии. Мочеточник бывает сдавлен на различном протяжении, расширен выше сдавления фиброзной тканью, оттеснен в медиальном направлении. В почках выявляется гидронефроз. Болезнь обычно бывает двусторонней и симметричной, но встречается и одностороннее сдавление мочеточника.
Лечение. В легких случаях, когда сдавление мочеточника является минимальным, проводится терапия кортикостероидами. Пациентам рекомендуют прекратить прием других препаратов, за исключением тех, без которых может возникнуть ухудшение другого заболевания. Резко выраженное сдавление мочеточника является показанием к оперативному лечению.